Терапия №7 / 2023
Перспективы использования нанотехнологий в эрадикации Helicobacter pylori
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, г. Санкт-Петербург
Аннотация. Современные схемы эрадикации H. pylori состоят в основном из комбинации двух антибактериальных средств, препарата висмута и ингибитора протонной помпы. Несмотря на усиленную терапию, частота эффективной эрадикации неуклонно снижается из-за роста антибиотикорезистентности H. pylori. В связи с этим представляется перспективной разработка антихеликобактерных препаратов с улучшенными фармакокинетическими показателями. Наноносители в этом плане обладают уникальными преимуществами: они способствуют повышению биодоступности лекарств, снижают деградацию антибиотиков в кислой среде желудка и обеспечивают целенаправленную доставку действующих веществ до мишени. Кроме того, нанопрепараты способствуют уничтожению биопленок H. pylori. В обзорной статье представлены результаты исследований, касающихся применения наночастиц на основе липидов, полимерных наночастиц и неорганических наночастиц для оптимизации лечения H. pylori-ассоциированных заболеваний.
ВВЕДЕНИЕ
Колонизация Helicobacter pylori (H. pylori) поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия H. pylori представляет собой использование комбинации двух антибактериальных средств, препарата висмута и ингибитора протонной помпы в течение 14 дней. Несмотря на усиленную терапию, частота эффективной эрадикации неуклонно снижается из-за усиления антибиотикорезистентности H. Pylori, что требует разработки «новых» антибиотиков. Показательный факт: еще в 2017 г. H. pylori, резистентный к кларитромицину, был включен Всемирной организацией здравоохранения в список 12 приоритетных возбудителей [1].
Известно, что создание новых антибактериальных средств, подходящих для эрадикации H. pylori, сопряжено с рядом трудностей. Основная проблема – высокая стоимость разработки и вывода на рынок нового препарата [2]. Усугубляет положение и то обстоятельство, что даже после успешной регистрации антибактериального препарата регуляторные органы, как правило, в целях предотвращения быстрого развития резистентности ограничивают обращение таких препаратов [3]. Вследствие этого крупные фармацевтические компании все чаще отказываются от исследований в области разработки новых антибиотиков.
В связи с вышесказанным представляется перспективной разработка структурно новых препаратов, представляющих собой уже одобренные антибактериальные средства, с использованием нанотехнологий [4].
Под термином «нанотехнологии» понимают совокупность методов и приемов, обеспечивающих возможность контролируемым образом создавать и модифицировать объекты, включающие компоненты с размерами менее 100 нм, имеющие принципиально новые качества и позволяющие осуществлять их интеграцию в полноценно функционирующие системы большего масштаба. Применение нанотехнологий является определенной альтернативой для улучшения и усиления эффекта существующих противомикробных препаратов.
Цель данной статьи – обзор результатов исследований в области нанотехнологий для оптимизации лечения H. Pylori-ассоциированных заболеваний и оценка дальнейших перспектив развития в области нанофармакологии.
ОСНОВНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ НАНОЧАСТИЦ
Одним из главных направлений нанотехнологии в лечении H. pylori является создание наночастиц, содержащих в своем составе молекулы антибактериальных средств. Первоначально основная задача таких наночастиц заключалась в защите лекарственных средств от агрессивной кислой среды желудка или повышении растворимости препарата [5, 6]. Позже исследователи обнаружили, что нанопереносчики, «нагруженные» антибиотиком, используют одновременно несколько механизмов для подавления роста или уничтожения H. pylori, что затрудняет развитие у бактерий лекарственной устойчивости.
Некоторые наночастицы обладают способностью проникать через барьеры слизистой оболочки или даже пенетрировать во внеклеточный слой матрикса микробных биопленок и вызывать его деградацию [7, 8]. Системы доставки лекарств на основе наночастиц могут взаимодействовать с бактериальной клеткой двумя разными механизмами [9]. При реализации первого механизма наночастица сливается (соединяется) с клеточной стенкой или клеточной мембраной микроорганизма и транспортирует молекулы антибиотика через них. С помощью другого механизма наночастицы адсорбируют отрицательно заряженные бактерии. Адсорбция увеличивает проницаемость мембраны, лекарственное средство непрерывно высвобождается на клеточной стенке и диффундирует внутрь бактериальной клетки [5, 9].
Таргетная доставка антибактериальных средств и их пролонгированное высвобождение нанопереносчиками позволяют достичь эффективной концентрации лекарственного препарата в бактериальных клетках-мишенях, что дает пероральным наноантибиотикам уникальные преимущества в плане уничтожения резистентных штаммов H. pylori. Кроме того, было обнаружено, что по сравнению с традиционными антибиотиками наночастичные системы менее токсичны при лечении [10].
Выделяют несколько категорий нанопереносчиков с антибиотиками, предназначенных для эрадикации H. pylori:
- наночастицы на основе липидов, такие как липосомы, твердые липидные наночастицы, наноструктурированные липидные носители и наноэмульсии (рис. 1);
- полимерные наночастицы – полимолочная и полигликолевая кислоты, полиэтиленгликоль, хитозан;
- неорганические наночастицы, такие как металлические наночастицы.
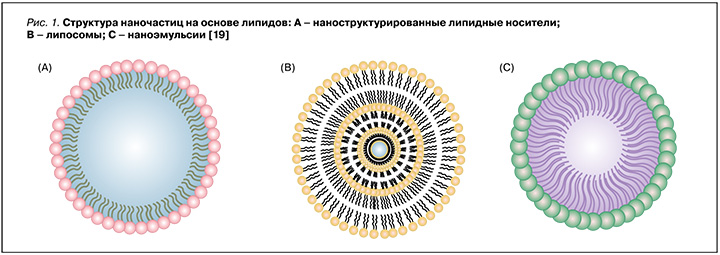
Существуют и другие нанопереносчики, причем каждый из них демонстрирует отличительные преимущества в доставке антимикробных препаратов.
В ряде научных работ сообщалось, что, помимо инкапсулирования ант...












