Акушерство и Гинекология №1 / 2020
Плацента при хронической болезни почек у беременных
1) ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», Москва, Россия;
2) ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия;
3) Институт прикладной математики им. М.В. Келдыша РАН, Москва, Россия
Цель. Изучить структурные особенности плаценты при хронической болезни почек (ХБП) у беременных.
Материалы и методы. Морфологическое исследование 124 плацент беременных с ХБП разных стадий в сроки 31–39 недель. Исследовали экспрессию Ki-67, CD31 в ворсинчатом цитотрофобласте, эндотелии капилляров, подсчитывали количество и площадь капилляров ворсин. Проводили клинико-морфологические сопоставления с использованием критериев непараметрической статистики и методов статистического исследования нечисловых объектов.
Результаты. С возрастанием степени тяжести основного заболевания со стадии ХБП2 прогрессивно снижаются перцентильная масса плаценты и весо-ростовые показатели новорожденного, отмечается стойкая тенденция к резкому уменьшению количества капилляров в ворсине, их сужению до нескольких мкм².
Заключение. Патогенез морфологических изменений плаценты при ХБП обусловлен преэклампсией.
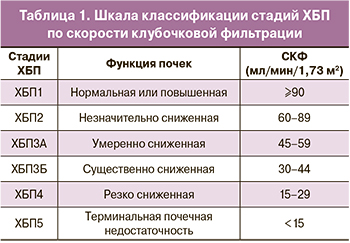
Беременность у пациенток с хроническими заболеваниями почек (ХЗП) характеризуется высоким уровнем перинатальной смертности и патологическими изменениями плаценты с множественными ее поражениями [1]. Характер и патогенез нефрологических заболеваний отличаются выраженным разнообразием – это врожденные аномалии развития почек и мочевыводящих путей, хронические персистирующие инфекции, а также иммуновоспалительные системные поражения, гипертоническая болезнь (ГБ), сахарный диабет (СД) с вторичным вовлечением почки в патологический процесс. С учетом международного опыта создана концепция ХБП, что не отменяет необходимости установления индивидуального нозологического диагноза. Диагноз ХБП устанавливается на основании критериев, сохраняющихся более 3 месяцев: альбуминурии (экскреция альбумина с мочой ≥30 мг/сут), изменений осадка мочи, электролитных и других нарушений вследствие канальцевой дисфункции, гистологических изменений (нефробиопсия), структурных нарушений при визуализирующих методах исследования, трансплантации почки, снижении скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2. Стадия ХБП у беременных определяется на основании показателей СКФ при проведении пробы Реберга (табл. 1).
 В редких описаниях при патологии почек отмечается задержка роста плаценты, вероятно, вследствие патологии маточно-плацентарных сосудов и гипертензии. При заболеваниях почек, не сопровождающихся артериальной гипертензией (АГ), плацента может быть не изменена, хотя масса ее и плода часто снижены. При заболеваниях почек в сочетании с АГ наблюдается патология сосудов децидуальной ткани, как и при преэклампсии (ПЭ), но в меньшей степени выраженная. У 30% пациенток с трансплантацией почки развивается ПЭ, иногда в сочетании с отторжением трансплантата [1, 2]. Частота акушерских и перинатальных осложнений четко коррелирует со стадией ХБП, показателями артериального давления (АД) и протеинурией [3]. Из-за разнообразия данных при относительно ограниченном числе наблюдений цель нашего исследования состояла в изучении структурных особенностей плаценты при ХБП.
В редких описаниях при патологии почек отмечается задержка роста плаценты, вероятно, вследствие патологии маточно-плацентарных сосудов и гипертензии. При заболеваниях почек, не сопровождающихся артериальной гипертензией (АГ), плацента может быть не изменена, хотя масса ее и плода часто снижены. При заболеваниях почек в сочетании с АГ наблюдается патология сосудов децидуальной ткани, как и при преэклампсии (ПЭ), но в меньшей степени выраженная. У 30% пациенток с трансплантацией почки развивается ПЭ, иногда в сочетании с отторжением трансплантата [1, 2]. Частота акушерских и перинатальных осложнений четко коррелирует со стадией ХБП, показателями артериального давления (АД) и протеинурией [3]. Из-за разнообразия данных при относительно ограниченном числе наблюдений цель нашего исследования состояла в изучении структурных особенностей плаценты при ХБП.
Материалы и методы
Группы исследования были сформированы соответственно стадиям ХБП: ХБП1 – 70, ХБП2 – 14, ХБП3 – 22, ХБП4 – 5, контроль (физиологическое течение беременности) – 13, всего 124 плаценты в сроки 31–39 недель беременности. Морфологическое исследование плаценты проводили после фиксации в формалине и гистологической обработки. Макроскопически учитывали наличие аномалий пуповины и плацентарного диска, массу последнего оценивали на основании разработанных нами ранее перцентильных показателей массы плаценты жительниц Московской области [4]. При гистологическом исследовании определяли соответствие зрелости ворсин сроку беременности, состояние трофобласта, межворсинчатого пространства, плодовых сосудов и стромы ворсин. Иммуногистохимическое (ИГХ) исследование (49 фрагментов) проводили в полуавтоматическом аппарате Thermo LAB Vision 480S по стандартной методике, рекомендованной производителем антител Thermo scientific. Исследовали экспрессию Ki-67 – маркера клеточной пролиферации (кроличьи моноклональные антитела, клон SP6), CD31 (клон JC/70A) для изучения особенностей сосудистого компонента ворсин хориона. Количественную оценку результатов иммуногистохимических реакций выполняли с использованием системы визуализации на микроскопе AxioImager.M2, цифровой камеры AxioCam MRc5 и программы Zen. Определяли интенсивность пролиферации ворсинчатого цитотрофобласта и эндотелия капилляров путем подсчета позитивно окрашенных ядер в 100 ворсинах при общем увеличении микроскопа 400. Васкуляризацию ворсинчатого хориона оценивали путем подсчета количества капилляров и измерения площади среза каждого из них и суммарную в 50 ворсинах при увеличении 400 с применением морфометрической части программы. Проводили сопоставление структурных особенностей плаценты с клиническими данными – наличием АГ (у 41 пациентки), ПЭ (у 31 – средней тяжести, у 5 – тяжелой), стадией ХБП, весо-ростовыми показателями новорожденного.
Для статистического анализа нами были использованы критерии непараметрической статистики: критерий Смирнова для сравнения двух эмпирических функций распределения – каждой группы с контрольной; критерий хи-квадрат – для оценки значимости зависимости признаков, т.е. определения взаимосвязи клинико-морфологической маски и стадии ХБП; критерий множественного сравнения Краскела–Уоллиса – для более надежной констатации различия между группами; результаты оценивали как статистически значимые при p<0,05. Мы применяли и вариант нечисловой статистики [5], основанный на формализации врачебных утверждений в виде логических переменных, не имеющих численной природы, но влияющих на решение врача о причинах заболевания и методах лечения. Для анализа нечисловой статистики в настоящее время нет коммерческих стандартных пакетов, что заставляет пользоваться авторскими разработками [6]. Состояние каждого пациента представлено в виде набора (вектора) символов, называемых далее «логическими симптомами». Решение о принадлежности пациента к определенной группе принимается по совпадению вектора симптомов пациента с образцом, свойственным этой группе. Такой образец называется «маской» группы – это вектор трехзначных...
60>











