STROKE №1 (41) / 2016
По результатам интегративных исследований с участием мышей и людей ANGPT1 и ZBTB7C являются генами, повышающими предрасположенность к ишемическому повреждению
Department of Neurosurgery and Channing Division of Network Medicine, Department of Medicine, Brigham and Women’s Hospital, Boston, MA; Department of Neurology, Massachusetts General Hospital, Boston; Department of Neurology and Psychiatry, Sapienza University of Rome, Rome, Italy; Department of Chemical Biology, Northwest Agriculture and Forestry University, Shaanxi, People’s Republic of China; Department of Neurosurgery, China-Japan Friendship Hospital, Beijing, People’s Republic of China; The Jackson Laboratory, Bar Harbor, ME; Division of Pulmonary, Allergy, and Critical Care Medicine, Department of Medicine and Department of Neurosurgery, University of Pittsburgh School of Medicine, PA; Quinnipiac University Frank H. Netter, MD School of Medicine, Hamden, CT; University of Massachusetts Medical School, Worcester; and Department of Neurology, Warren Alpert Medical School of Brown University, Providence, RI
Предпосылки и цель исследования. На степень ишемического повреждения в ответ на церебральную ишемию, как известно, влияет состояние сосудов. Тем не менее недостаточно хорошо изучены несосудистые и динамические сосудистые реакции и их генетические основы. Методы. Мы провели исследование полногеномной ассоциации с участием 235 мышей из 33 инбредных штаммов с использованием модели окклюзии средней мозговой артерии. Структуру популяции и генетическое родство учитывали с использованием эффективного метода объединения смешанных моделей. Человеческие ортологи к генам, ассоциированным со значимыми и предположительными однонуклеотидными полиморфизмами по результатам исследования среди штаммов мышей, изучали у пациентов с окклюзией М1 сегмента средней мозговой артерии, поступивших на лечение с признаками и симптомами острого ишемического инсульта. Результаты.
Мы выявили 4 полногеномных значимых и предположительных однонуклеотидных полиморфизма, ассоциированных с объемом очага инфаркта у мышей (rs3694965, р=2,17×10-7; rs31924033, р=5,61×10-6; rs32249495, р=2,08×10-7; rs3677406, р=9,56×10-6). rs32249495, который соответствует ангиопоэтину-1 (ANGPT1), также имеет значимость в рецессивной модели у человека, тогда как rs1944577, соответствующий ZBTB7C, был номинально значимым в аддитивной и доминатной генетических моделях у людей. Было показано, что ZBTB7C активируется в эндотелиальных клетках в моделях ишемии in vitro и in vivo. Выводы. Генетические вариации ANGPT1 и ZBTB7C ассоциированы с увеличением размера очага инфаркта у мышей и людей. ZBTB7C способен модулировать реакцию на ишемию посредством апоптоза нейронов и динамической коллатерализации и в совокупности с ANGPT1 может служить в качестве потенциальной новой мишени для лечения церебральной ишемии.
Церебральная ишемия остается серьезной проблемой общественного здравоохранения, ежегодно во всем мире регистрируют >20 млн случаев инсульта, что делает его третьей ведущей причиной смерти [2] и ведущей причиной инвалидности у взрослых [1]. Общеизвестно, что размер очага инфаркта головного мозга после ишемического инсульта (ИИ) зависит от степени коллатерализации сосудов. Влияние состояния сосудов на объем очага инфаркта было показано в моделях инсульта у грызунов, в которых у различных штаммов мышей регистрировали различные объемы инфаркта головного мозга после окклюзии средней мозговой артерии – ОСМА [3]. В исследовании с участием нескольких штаммов мышей показали, что замкнутость Виллизиева круга, в частности наличие P1 сегмента задней мозговой артерии (ЗМА), влияет на степень церебральной перфузии и размер инфаркта после ОСМА [4, 5]. Также было продемонстрировано, что размер очага инфаркта зависит от наличия нативных пиальных коллатералей [6]. Однако существуют и другие факторы, кроме состояния нативных сосудов, модулирующие степень ишемического повреждения. Одним из этих компонентов является динамическое ремоделирование сосудов, происходящее при ишемическом повреждении [7]. Совсем недавно было показано, что различия в объемах очагов ишемического повреждения у разных штаммов мышей в моделях окклюзии дистального сегмента средней мозговой артерии (СМА) связаны с генетическими вариациями интегрина альфа-L, независимо от наличия коллатералей [8, 9]. В настоящем исследовании мы использовали модель проксимальной ОСМА у 235 мышей из 33 инбредных штаммов для изучения генетической основы реакции на ишемию. В этом исследовании мы продемонстрировали, что анатомия крупных сосудов недостоверно коррелирует с размером очага инфаркта мозга. Благодаря интеграции результатов исследования штаммов и результатов исследований среди людей мы выявили, что ANGPT1 и ZBTB7C являются генами, повышающими предрасположенность к развитию ишемического повреждения.
 МЕТОДЫ
МЕТОДЫ
Модель ОСМА
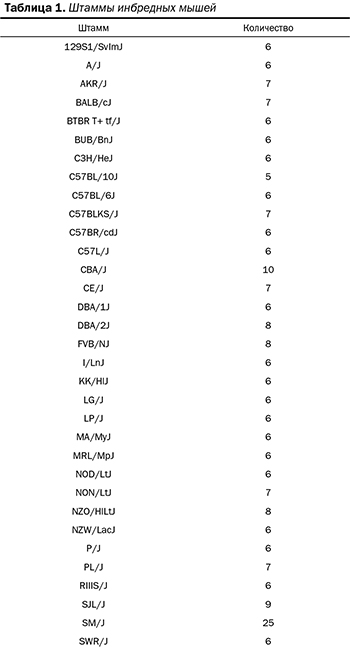
Тридцать три инбредных штамма мышей приобрели в лаборатории Jackson Laboratory (таблица 1). В произвольном порядке выполнили модель перманентной ОСМА у 5–25 мышей каждого штамма (всего 235 мышей). Для модели ОСМА использовали самцов мышей в возрасте от 8 до 10 недель (14–45 г). Модель ОСМА выполняли описанным ранее методом [10], детальное описание которого доступно в дополнительных данных on-line. Число мышей каждого штамма, исключенное из анализа по причине неудачной операции или смерти, представлено в таблице I в дополнительных данных on-line. Физиологические параметры каждого штамма мышей подробно описаны в таблице II в дополнительных данных on-line. При содержании животных и проведении экспериментов соблюдали стандарты и правила Комитета по уходу и использованию лабораторных животных нашего учреждения.
Вещество головного мозга разрезали на коронарные срезы толщиной 1 мм с использованием специальной матрицы и инкубировали в 2% растворе хлористого трифенилтетразолинхлорида (Sigma, Сент Луис, Миссури) при комнатной температуре в течение 15 минут. Общий объем очага инфаркта рассчитывал путем суммирования площадей очагов инфарктов во всех срезах исследователь, ослепленный относительно генетических данных на момент измерения. Косвенный метод Swanson [11] использовали в случае, когда относительный объем очага ишемического повреждения рассчитывали как: (объем контралатерального полушария-объем интактного вещества мозга ипсилатерального полушария)/объем контралатерального полушария.
Оценка состояния Виллизиева круга
Виллизиев круг визуализировали с использованием перфузии Китайской тушью, как было описано ранее [12] и детализировано в дополнительных данных on-line.
Эту процедуру выполнили у мышей 13 штаммов: 129S1/SvImJ, A/J, BALB/cJ, BTBR T+ tf/J, C57BL/10J, C57BL/6J, C57BLKS/J, C57L/J, DBA2/J, KK/HlJ, NOD/LtJ, P/J и SWR/J. Использовали от 4 до 7 животных каждого штамма. Отношение диаметра P1 сегмента левой ЗМА к диаметру ВСА в зоне ее бифуркации измеряли с помощью программного обеспечения ImageJ 1.43 (Национальные институты здравоохранения).
Анализ полногеномных ассоциаций
Картирование полногеномных ассоциаций с характеристиками инфаркта мозга как фенотипа проводили в 33 инбредных штаммах мышей с использованием R пакета и emma, когда эффективный метод объединения смешанных моделей использовали для корректировки структуры популяции и генетического родства у инбредных мышей [13]. Применяли наборы Broad mouse HapMap SNP, содержащие 132 285 однонуклеотидных полиморфизмов (ОНП) (http://www.broadinstitute.org/mouse/hapmap/, http://mouse.cs.ucla.edu/mousehapmap/emma.html).
Используя R пакет nortest [14], тест нормальности Андерсона–Дарлинга применяли для оценки нормальности распределения значений объемов очагов инфарктов мозга. Значения р скорректировали для множественного сравнения с помощью алгоритма частоты ложного обнаружения по Бенджамини и Хосбергу [15] (значения Q). ОНП с р<10-5 считали предположитель...