STROKE №1 (37) / 2015
Понимание функций эндогенного и экзогенного тканевого активатора плазминогена при инсульте
INSERM UMR-S U919 Serine Proteases and Pathophysiology of the Neurovascular Unit, Université Caen Basse Normandie, GIP Cyceron, Caen, France (F.D., J.P., C.A., D.V.); and Center for Molecular and Vascular Biology, KU Leuven, Leuven, Belgium (R.L.).
Альтеплаза (Актилизе или Активазе) является золотым стандартом лечения ишемического инсульта в остром периоде [1] и заслуживает внимания в отношении лизиса гематомы при геморрагическом инсульте. Действующим веществом Альтеплазы является рекомбинантная форма эндогенной протеазы, тканевого активатора плазминогена (ТАП). Его внутрисосудистая тромболитическая активность хорошо известна, но менее изучены его многогранные функции в центральной нервной системе (ЦНС). Эндогенный ТАП не только высвобождается в кровь эндотелиальными клетками, но также экспрессируется многими клетками в паренхиме головного мозга (дополнительные данные on-line), и практически он может оказывать влияние на все типы клеток головного мозга. Эндогенный ТАП участвует в осуществлении все большего количества функций головного мозга, некоторые из которых являются весьма актуальными во время и после развития инсульта. Важно отметить, что знания о механизмах действия эндогенного тканевого активатора плазминогена могут быть актуальны и в отношении рекомбинантного тканевого активатора плазминогена.
В настоящем обзоре мы предоставляем современные данные о ферментативных или цитокин-подобных эффектах действия ТАП в ЦНС, его различных молекулярных субстратах или рецепторах, сосредоточив внимание на процессах, происходящих во время и после ишемического или геморрагического инсульта, в т.ч. на эксайтотоксичности, апоптозе, разрушении гематоэнцефалического барьера, воспалении, повреждении аксонов и демиелинизации.
ТАП больше, чем фибринолитический фермент
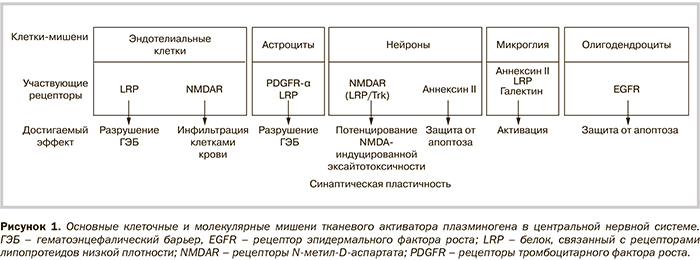
ТАП является мозаичной протеазой из 527 аминокислот, имеющей в своем составе 5 различных модулей: пальцевой домен, эпидермальный фактор роста (ЭФР)-подобный домен, 2 петлевых домена (K1 и K2), и протеолитический домен сериновой протеазы. Посредством этих доменов ТАП может взаимодействовать с различными связывающими белками и рецепторами в паренхиме головного мозга, таким образом выполняя функции, отличные от простого преобразования плазминогена в плазмин (рис. 1).
Сам по себе ТАП не является фибринолитическим ферментом. Для выполнения фибринолиза ТАП преобразует связанный с фибрином плазминоген в плазмин. Связывание плазминогена с фибрином является необходимым этапом в изменении его закрытой конформации в открытую форму, что обеспечивает его расщепление с помощью ТАП [2]. Пальцевой домен ТАП участвует в его связывании в фибрином и необходим для обеспечения фибринолитической активности при низкой концентрации активатора плазминогена [3]. В головном мозге пальцевой домен, взаимодействуя с белками, связанными с рецепторами липопротеидов низкой плотности (LRP), обеспечивает проницаемость гематоэнцефалического барьера (ГЭБ) [4], клиренс астроцитов [5] или активацию микроглии [6, 7].
ЭФР-подобный домен гомологичен ЭФР и, соответственно, опосредует трофические и митогенные функции ТАП в головном мозге [8–11]. Было показано, что O-гликозилирование ЭФР-подобного домена способствует повторному захвату ТАП печенью [12].
Роль домена К1 в мозге плохо изучена, но его высоко маннозный тип гликозилирования может принимать участие в процессах захвата, как это показано в отношении эндотелиальных клеток печени через рецепторы к маннозе [13]. Из-за наличия петли и связывающего лизин сайта, К2 домен связывается с различными белками в крови и в паренхиме головного мозга, в т.ч. тромбоцитарным фактором роста-CC [14], рецепторами N-метил-d-аспартата (NMDAR) [15] или с протеином группы белков с высокой подвижностью-1 [16]. В домене K2 сайт гликозилирования Asn184 различает 2 варианта ТАП (тип I – полностью гликозилированный, тип II – без гликозилирования) [17], которые могут выполнять разные функции, хотя это еще предстоит изучить. Интересно, что десмотеплаза, тромболитический препарат, используемый в клинических испытаниях десмотеплазы при остром ишемическом инсульте (DIAS), полученной из слюнной железы летучих мышей, по своей структуре очень напоминает ТАП, но в нем нет K2 домена [18] и, соответственно, он лишен токсических воздействий, скорее всего из-за неспособности взаимодействовать с NMDAR [19, 20]. Кроме того, специфические аминокислоты, входящие в основную структуру связывающего лизин сайта, также играют ключевую роль в способности ТАП обеспечивать эксайтотоксичность на нейроны [21].
Каталитический домен поддерживает функции Тап в зависимости от протеазной активности. Специфическое расщепление на связанном пептиде Arg275-Ile276 преобразует одноцепочечную форму в двухцепочечную, структура которой поддерживается за счет дисульфидных связей. В отличие от других членов химотрипсинового семейства сериновых протеаз ТАП активен в одноцепочечной и в двухцепочечной формах. Тем не менее некоторые функции ТАП являются специфичными для одной из форм: например только в виде одноцепочечной формы ТАП может обеспечивать NMDAR-связан...












