Фарматека №7 / 2020
Применение алпелисиба для лечения HR+ HER2- метастатического рака молочной железы у пациентов с мутацией PIK3CA: результаты исследования SOLAR-1
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия;
2) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия;
3) Первый СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург, Россия
Эффективность комбинированной эндокринной терапии в лечении больных HR+HER2- метастатическим РМЖ
В соответствии с российскими и международными клиническими рекомендациями в настоящее время основой лечения больных HR+HER2-метастатическим раком молочной железы (мРМЖ) без висцерального криза является эндокринная терапия [1–4]. Доказано, что добавление таргетных препаратов, в т.ч. ингибиторов циклинзависимых киназ CDK4/6, к гормонотерапии ингибиторами ароматазы или фулвестранту практически в 1,5–2 раза статистически достоверно увеличивает показатели медианы выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ; табл. 1), сохраняет качество жизни больных HR+HER2-мРМЖ.
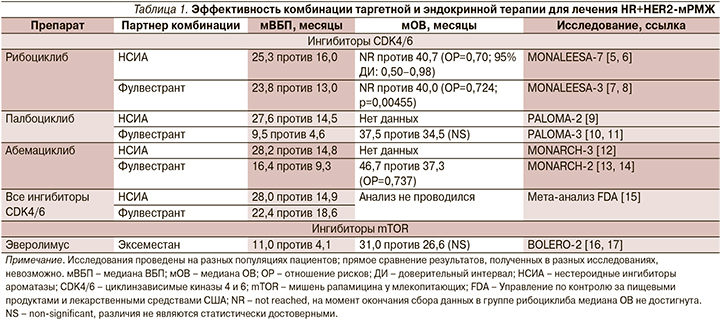
Эффективность системной терапии пациентов c HR+HER2-мРМЖ
Ген PIK3CA кодирует каталитическую субъединицу фермента фосфатидилинозитол-3-киназы (PI3K). В норме PI3K участвует в передаче сигнала от рецепторов ростовых факторов, стимулируя в конечном счете выживание и деление клетки [18, 19].
В клетках опухоли в результате спонтанных мутаций образуется гиперактивная форма PI3K, которая стимулирует пролиферацию в отсутствие внешних стимулов (ростовых факторов и пр.).
Мутация PIK3CA встречается среди 40% пациентов с HR+HER2-мРМЖ и служит фактором неблагоприятного прогноза, т.к. ассоциируется с более агрессивным течением заболевания и худшим ответом на химиотерапию, гормонотерапию и таргетную терапию (ингибиторам CDK4/6 и mTOR) [20–23].
На протяжении 20 лет в клинических испытаниях предпринимались попытки блокировать фермент фосфатидилинозитол-3 киназу (PI3K). Однако всякий раз исследователи сталкивались с проблемой вынужденного прекращения клинических исследований препаратов класса анти-PI3K по причине развития массы побочных эффектов, что связано с важной ролью, которую PI3K играет в поддержании жизнеспособности клеток [24–26]. В результате спонтанных мутаций гена PIK3CA образуется гиперактивная форма фосфатидилинозитол-3 киназы, которая стимулирует пролиферацию злокачественных клеток в отсутствие внешних ростовых факторов.
В исследовании BELLE-2 у пациентов с HR+HER2-мРМЖ с мутацией PIK3CA в опухоли, получавших таргетную терапию бупарлисибом (ингибитор всех изоформ PI3K), медиана ОВ составила 26,0 месяцев против 24,8 месяца в группе плацебо; однако различия не были статистически значимыми (p=0,127). При этом частота нежелательных явлений была существенно выше в группе бупарлисиба. Частота гипергликемии в группе бупарлисиба составила 43% против 8% в группе плацебо, повышения АЛТ – 40% против 7%, повышения АСТ – 38% против 10%, тошноты – 40% против 24% соответственно (анализ общей популяции пациентов с HR+HER2- мРМЖ) [24].
Эффективность таселисиба (ингибитора α-, γ- и δ-изоформ PI3K) была весьма скромной, по мнению исследователей. Медиана ВБП у пациентов с HR+HER2-мРМЖ с мутацией PIK3CA в опухоли, получавших таселисиб с фулвестрантом, составляла 7,4 месяца против 5,4 месяца в группе плацебо с фулвестрантом (ОР=0,70; 95% ДИ: 0,56–0,89; p=0,0037), а нежелательные явления встречались значительно чаще: диарея – 60% против 20%, гипергликемия – 40% против 9%, тошнота – 34% против 24, стоматит – 33% против 9%, сыпь – 25% против 11% соответственно [26].
Разработка селективного ингибитора α-изоформы PI3K впервые позволила достичь баланса эффективности и безопасности терапии пациентов с PIK3CA+HR+HER2-мРМЖ. В исследовании Ib-фазы с включением сведений о 87 пациентах с HR+HER2-мРМЖ показано, что алпелисиб в дозе 300 мг/день в комбинации с фулвестрантом обладает контролируемым профилем токсичности. При этом медиана ВБП составила 9,1 месяца в группе пациентов с мутацией гена PIK3CA против 4,7 ...












