Клиническая Нефрология №2 / 2018
Ранние маркеры развития и прогрессирования рефлюкс-нефропатии у детей
1 ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» МЗ РФ; Москва, Россия;
2 Кафедра педиатрии и инфекционных болезней ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» МЗ РФ; Москва, Россия;
3 Научно-исследовательский институт охраны здоровья матери и ребенка; Кишинев, Молдова
Высокая распространенность инфекции мочевой системы (ИМС) на фоне пузырно-мочеточникового рефлюкса (ПМР) в детской популяции, а также склонность к рецидивирующему течению и развитию необратимых повреждений паренхимы почек c развитием артериальной гипертензии и хронической почечной недостаточности (ХПН) обосновывают необходимость дальнейшего изучения этой проблемы [1, 2]. По данным European Renal Association-European Dialysis Transplant Association (2010), частота тубулоинтерстициальных заболеваний, в том числе рефлюкс-нефропатии (РН) c развитием ХПН у детей с ПМР составляет до 22%, по данным различных авторов, от 6 до 27,5% [3–6]. Трудность диагностики определения степени тяжести ренального повреждения на фоне ПМР без проведения реносцинтиграфии с ДМСА (2,3-димеркаптосукциновая кислота) затруднительна [7]. В изучении данной проблемы актуально и следующее: до настоящего времени нет достаточно достоверных маркеров, прогнозирующих ранее прогрессирующее течение РН [8]. Поиск т.н. маркеров хронического почечного повреждения, позволяющих проводить раннее выявление и характер патологических изменений в почках, дифференцировать поражение разных отделов нефрона, точно установить стадию процесса, оценить выраженность воспаления и интенсивность фиброгенеза, наиболее важен [8–10].
Проведенное исследование Е.М. Чичуги и соавт. (2015), целью которого стало выявление маркеров на ранних стадиях почечного повреждения, показало, что у детей с обструкцией мочевых путей или с ПМР маркерами стали протеинурия, артериальная гипертензия, снижение функционального почечного резерва и нарушение кортикального кровотока, по данным цветного допплеровского картирования. Авторами также была подтверждена их значимость как ранних маркеров прогрессирования хронической болезни почек (ХБП) [11]. Однако, по данным других авторов, эти маркеры информативны при длительно текущем почечном поражении, когда развились основные осложнения почечного процесса, поэтому не могут быть ранними и использоваться в качестве прогностических маркеров [12, 13]. В настоящее время активно изучаются трансформирующий фактор роста (TФР-β1), интерлейкины-6 (ИЛ-6), ИЛ-8, -10, KIM-1 (kidney injury molecule-1), VEGF-А (vascular endothelial growth factor-A), L-FABP (liver type fatty-acid binding protein), NGAL (neutrophil gelatinase-associated lipocalin) и другие в качестве маркеров для раннего выявления почечного повреждения при ПМР [14].
TФР-β1 – мультифункциональный цитокин, регулирующий нормальный рост клеток и их дифференциацию во время эмбриогенеза, а также играющий ведущую роль в развитии фиброза ткани после ее повреждения. Источником служат макрофаги, тромбоциты, фибробласты, активированные Т-лимфоциты, клетки эндотелия сосудов и канальцев. В ответ на повреждение почечной ткани TФР-β1 вызывает трансформацию тубулярных эпителиальных клеток в миофибробласты, действуя как мощный стимулятор пролиферации фибробластов, стимулирует продукцию экстрацеллюлярных матричных белков (фибронектина, протеингликанов), активирует продукцию и накопление в интерстиции и в базальной мембране коллагенов I, III, IV типов [15].
 Ангиотензин II (АngII) – вазоактивный белок, а также истинный цитокин, который регулирует рост клетки, пролиферацию и дифференциацию моноцитов в макрофаги, а также синтез нескольких провоспалительных медиаторов и факторов роста, таких как TФР-β1, что способствует поддержанию воспаления и формированию фиброза. При заболеваниях почек и ХПН усиливается внутрипочечная продукция АngII [16].
Ангиотензин II (АngII) – вазоактивный белок, а также истинный цитокин, который регулирует рост клетки, пролиферацию и дифференциацию моноцитов в макрофаги, а также синтез нескольких провоспалительных медиаторов и факторов роста, таких как TФР-β1, что способствует поддержанию воспаления и формированию фиброза. При заболеваниях почек и ХПН усиливается внутрипочечная продукция АngII [16].
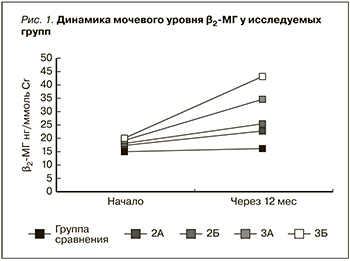
β2-микроглобулин (β2-МГ) – среднемолекулярный белок с массой 11,8 КД, присутствующий на поверхности всех ядросодержащих клеток и содержащийся во всех жидкостях организма. У здоровых людей скорость продукции этого белка и элиминация постоянны. β2-МГ выводится из организма почками на уровне клубочков, а в проксимальных канальцах проходят его реабсорбция и катаболизм. При нарушении процессов клубочковой фильтрации и канальцевых дисфункциях содержание β2-МГ увеличивается в крови и он появляется в моче [17, 18].
Таким образом, в литературе недостаточно освещен вопрос о роли АngII в патогенезе развития РН и не определена его роль в прогнозировании прогрессирования почечного повреждения. Известно, что, являясь основным профиброгенным фактором, инициирующим и поддерживающим процессы фибриллогенеза, Аng II повышает синтез TФР-β1, который стимулирует пролиферацию клеток и образование соединительной ткани [19–22]. Поскольку мочевой уровень β2-МГ отражает степень повреждения проксимальных канальцев можно предположить, что его повышенный уровень в моче будет отражать тяжесть повреждения тубулоинтерстициальной ткани, что характерно для РН [23, 24].
Целью исследования было определение клинического значения мочевой экскреции ТФР-β1, AngII и β2-МГ у детей с ПМР для раннего выявления и прогнозирования прогрессирования РН.












