Клиническая Нефрология №2 / 2014
Результаты Консультативного совета экспертов «Место кальцимиметиков в современных клинических рекомендациях по МКН-ХБП в свете результатов новых исследований с применением цинакалцета»
1 ГБУЗ «Городская Мариинская больница» – Городской нефрологический центр, Санкт-Петербург; 2 Северо-Западный ГМУ им. И.И. Мечникова, кафедра внутренних болезней и нефрологии
По инициативе Российского диализного общества в Москве 5 марта 2014 г. состоялось заседание Консультативного совета «Место кальцимиметиков в современных клинических рекомендациях по МКН-ХБП в свете результатов новых исследований».
Совет был созван в преддверие подготовки обновления Национальных российских рекомендаций по минеральным и костным нарушениям при хронической болезни почек (МКН-ХБП), созданных и опубликованных Российским диализным обществом (РДО) [1] в 2011 г. после выхода в свет Клинических практических рекомендаций по диагностике, оценке, профилактике и лечению МКН-ХБП; KDIGO, 2009 г. [2].
После обсуждения новых данных клинических исследований экспертами была подписана резолюция.
Во вступительном докладе председатель совета, председатель РДО А.М. Андрусёв обосновал исключительную актуальность обновления Национальных рекомендаций. Со времени выхода рекомендаций KDIGO и национальных рекомендаций опубликовано значительное количество эпидемиологических наблюдательных исследований, открытых интервенционных исследований и несколько важных многоцентровых рандомизированных контролируемых исследований, существенным образом повлиявших на представление о патогенезе МКН-ХБП, методах обследования и динамического наблюдения, а также лечения.
За те же годы лечение ХБП (как и большинства других нозологий) перешло в систему обязательного медицинского страхования, где актуальные клинические рекомендации особенно важны, поскольку служат основой формирования стандартов оказания медицинской помощи, которые в свою очередь во многом определяют полноту доступного обследования и лечения основной массы пациентов.
К работе консультативного совета были привлечены в основном авторы национальных рекомендаций, чтобы наилучшим образом обеспечить преемственность и развитие содержащихся в них положений и при необходимости добавить новые.
В ходе консультативного совета авторитетные специалисты представили углубленные обзоры по нескольким актуальным тематикам, а отдельные важные положения или целевые значения параметров выносились на панельную дискуссию.
Основываясь на данных Российского регистра пациентов на заместительной почечной терапии РДО, А.М. Андрусёв продемонстрировал широкую распространенность МКН-ХБП среди диализных пациентов, при этом выраженность вторичного гиперпаратиреоза (ВГПТ) существенно превышает таковую во многих странах мира, а частота адекватного использования стандартной, тем более инновационной, терапии очевидно недостаточна; серьезнейшей проблемой является и широкая распространенность гиперфосфатемии, в значительной части случаев связанной в т.ч. с ВГПТ.
Если исторически ренальная остеодистрофия (термин, использовавшийся в широком понимании до публикации «Изложения позиции KDIGO» [3] в 2005 г.) в основном рассматривалась как костная патология, связанная с высокой или низкой скоростью обмена в кости, то в последние годы стало ясно, что главной составляющей МКН-ХБП, во многом определяющей прогноз лечения пациента в целом, является сосудистая и клапанная кальцификация.
Методы выявления сосудистой кальцификации в свете отбора пациентов на различные варианты активной терапии обсуждены в докладе В.Ю. Ряснянского. Основные причины сосудистой кальцификации: нарушение баланса между ингибиторами и промоутерами кальцификации, а также факторы, способствующие трансдифференцировке гладкомышечных клеток в остеоциты. К факторам, характерным для общей популяции, присоединяются специфические для ХБП: повышенный уровень кальция и фосфатов, дефицит ряда ингибиторов кальцификации, а также неудачно подобранная терапия.
Известно, что по мере снижения СКФ возрастает риск кальцификации коронарных артерий – в 1,68 раза для СКФ 50–59 мл/мин и в 2,82 раза для СКФ менее 30 мл/мин [4].
У диализных пациентов связь выживаемости с тяжестью кальцификации выявляется при оценке последней различными методами (рентгенография, скорость пульсовой волны, пульсовое давление) [5]. Причем зависит выживаемость именно от скорости прогрессирования кальцификации [6]. Важно поэтому определить оптимальные методы оценки сосудистой кальцификации, в т.ч. и для выбора оптимальной терапии. Компьютерная томография остается референсным методом для оценки кальцификации коронарных сосудов и аорты, обеспечивает количественную оценку, позволяет осуществлять последовательный мониторинг прогрессирования кальцификации; дает информацию о кальцификации клапанов, а заодно – и о плотности грудного отдела позвоночника. Однако при этом нет возможности провести дифференциальную диагностику между кальцификацией интимы и медии, а стоимость исследования и лучевая нагрузка высоки; воспроизводимость зависит от метода подсчета шкалы кальцификации (Агатстона или волюметрический) и от опыта интерпретации полученных изображений. Ультразвуковая диагностика кальцификации безопасна и относительно дешева, позволяет оценивать кальцификацию поверхностных сосудов, но ее результаты значимо зависят от опыта оператора, а корреляция с кальцификацией коронарных сосудов ограниченна, как и не существует четких данных о связи ее результатов с летальностью пациентов с поздними стадиями ХБП. Еще в большей степени от опыта оператора зависит интерпретация результатов оценки кальцификации клапанов при эхокардиографическом исследовании. Результаты измерения скорости пульсовой волны зависят от жесткости сосудов, в основном отражающей степень кальцификации, но исследование это малодоступно, является операторзависимым и фактически непрямым методом оценки кальцификации.
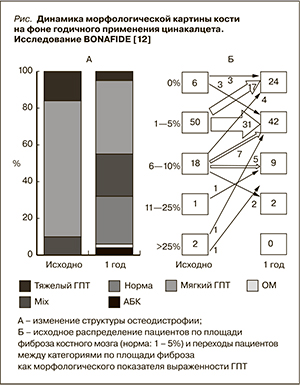 На этом фоне рентгеновские методы отличаются низкой ценой и лучевой дозой, высо...
На этом фоне рентгеновские методы отличаются низкой ценой и лучевой дозой, высо...












