Терапия №4 / 2023
Роль адипокинов и толщины эпикардиальной жировой ткани в прогнозировании исходов острого коронарного синдрома
1) ГБУЗ «Камчатская краевая больница им. А.С. Лукашевского», г. Петропавловск-Камчатский;
2) ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, г. Санкт-Петербург;
3) ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» Минздрава России
Аннотация. Эпикардиальный жир с учетом его анатомических и физиологических особенностей на протяжении многих лет рассматривается как важный фактор в патогенезе сердечно-сосудистых заболеваний (ССЗ).
Цель – оценка возможности прогнозирования негативного течения стенокардии в течение года после госпитализации по поводу острого коронарного синдрома на основании толщины эпикардиального жира и концентрации адипокинов у лиц с метаболическими нарушениями.
Материал и методы. Исследовано 38 женщин и 64 мужчин с повышенной массой тела или ожирением, медиана возраста 62 [55; 67] года, госпитализированных по поводу нестабильной стенокардии среднего или высокого риска по шкале Grace 2.0. При поступлении выполнен опрос, осмотр, лабораторное тестирование с определением уровня лептина, адипонектина, фактора некроза опухоли-альфа (ФНО-α) и интерлейкина (ИЛ-6). Стентирование коронарных артерий выполнено на 1–3-е сут с момента госпитализации. Эхокардиография на 2–4-е сут по стандартному протоколу с измерением толщины эпикардиального жира (ТЭЖ) по длинной оси левого желудочка в конце систолы. Пациенты были разделены на две группы в зависимости от ТЭЖ: 1-я группа – ТЭЖ до 7,6 мм (n=46); 2-я группа – ТЭЖ >7,6 мм (n=56). Через 12 мес контрольный визит пациентов, в рамках второго этапа исследования. Всего обследовано 89 лиц (87,2%) – 44 из 1-й группы и 45 из 2-й.
Результаты. Динамика лабораторных показателей в 1-й группе была обнаружена относительно уровня адипонектина (р=0,001), лептина (р=0,001), ИЛ-6 (р=0,001) и ФНО-α (р=0,001), во 2-й группе – уровня лептина (р=0,001), ФНО-α (р=0,001) и ИЛ-6 (р=0,001). Значимые различия ЭхоКГ-признаков в динамике в 1-й группе были выявлены по показателям конечно-диастолического объема (КДО) и конечно-систолического объема (КСО; р=0,001), во 2-й группе – по показателям фракции выброса левого желудочка (ФВ ЛЖ; р=0,001), КДО и КСО (р=0,001). Статистически значимое влияние на вероятность утяжеления стенокардии оказывали следующие факторы: уровень лептина – 1,08 (95% ДИ: 1,0–1,16; р=0,046), значение ФВ ЛЖ – 0,66 (95% ДИ: 0,52–0,84; р=0,001) и ТЭЖ – 2,18 (95% ДИ: 1,21–3,93; р=0,010).
Заключение. ТЭЖ более 7,6 мм, повышенная концентрация лептина и сниженная ФВ ЛЖ явились независимыми предикторами неблагоприятного течения стенокардии в течение 12 мес у лиц с нестабильной стенокардией и метаболическими нарушениями.
ВВЕДЕНИЕ
Ишемическая болезнь сердца (ИБС) по сей день остается наиболее распространенным заболеванием сердечно-сосудистой системы, которая является основной причиной смертности и инвалидизации населения в большинстве стран [1]. К наиболее распространенным формам ишемической болезни сердца относятся стабильная стенокардия, нестабильная стенокардия, инфаркт миокарда (с подъемом и без подъема сегмента ST) и/или внезапная сердечная смерть [1, 2] За последние десятилетия наблюдалось снижение смертности от этой группы заболеваний, в первую очередь за счет снижения острых инфарктов миокарда с подъемом сегмента ST, благодаря созданию доступной сети сосудистых центров, однако острый коронарный синдром (ОКС) без подъема сегмента ST, включая нестабильную стенокардию, сохраняет свои лидирующие позиции среди причин смертности [1, 2]. В связи с этим поиск воспроизводимых маркеров неблагоприятного течения ишемической болезни сердца не теряет своей актуальности.
Жировая ткань на протяжении многих лет рассматривается как важный фактор в патогенезе сердечно‐сосудистых заболеваний (ССЗ), в первую очередь за счет высвобождения активных молекул в системный кровоток [3, 4]. Однако, помимо висцерального жира, исследователи в последнее время были сосредоточены на роли локальных жировых депо в патогенезе ССЗ. В этом аспекте эпикардиальному жиру отводится потенциально важная роль в патофизиологии ИБС, учитывая наличие его метаболической активности и тесной анатомической близости с сердцем [4, 5].
Таким образом, целью исследования стала оценка возможности прогнозирования негативного течения стенокардии в течение года после госпитализации по поводу ОКС на основании толщины эпикардиального жира и концентрации адипокинов у лиц с метаболическими нарушениями.
МАТЕРИАЛ И МЕТОДЫ
В исследование вошли мужчины и женщины (медиана возраста составила 62 [55; 67] года), госпитализированные в отделение неотложной кардиологии регионального сосудистого центра в 2018–2019 гг. с диагнозом «нестабильная стенокардия». Пациенты имели средний или высокий риск по шкале Grace 2.0. Диагноз «нестабильная стенокардия» был выставлен на основании клинических рекомендаций Российского кардиологического общества для пациентов с ОКС без стойкого подъема сегмента ST электрокардиограммы (2020), рекомендаций Европейского общества кардиологов (ESC) по ведению пациентов с ОКС без стойкого подъема сегмента ST (2020) [1, 6].
Исследование было проведено в соответствии с принципами Хельсинской декларации, протокол исследования одобрен независимым локальным этическим комитетом. Все пациенты дали информированное согласие на участие и обработку результатов исследования.
Критерии включения в исследование: пациенты мужского и женского пола от 40 до 80 лет; наличие подписанного добровольного информированного согласия на участие в исследовании; наличие диагноза «нестабильная стенокардия» со средним и высоким риском по шкале Grace 2.0; наличие синусового ритма по электрокардиограмме.
Критерии невключения: отсутствие гемодинамически значимого поражения коронарного русла и отсутствие показаний для стентирования коронарных артерий; неудовлетворительная визуализация при трансторакальной эхокардиографии; постоянная форма фибрилляции предсердий; атриовентрикулярная блокада II–III степени; возраст пациента менее 18 лет; гемодинамически значимые пороки сердца; анемия средней и тяжелой степени.
Исследование выполнялось в два этапа. На первом, помимо сбора анамнеза, всем участникам проводилось клиническое обследование с включением оценки антропометрических показателей (измерялись окружность талии и окружность бедер с последующим расчетом отношения окружности талии к окружности бедер, рост и вес тела). Измерение уровня артериального давления (АД) осуществлялось по методу Н.С. Короткова [7, 8]. Клинико-анамнестическая характеристика групп представлена в таблице 1.
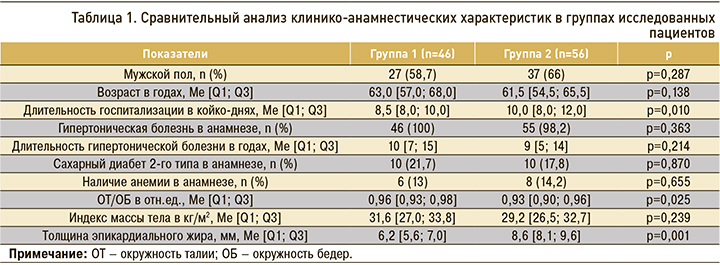
Было выполнено стандартное лабораторное тестирование на анализаторе COBAS INTEGRA 400 plus (Roche) для пациентов с ОКС, дополнительно определялась концентрация адипокинов (лептина, адипонектина) и провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли-альфа).
Чрескожное коронарное вмешательство и стентирование одной или нескольких коронарных артерий было проведено в первые трое суток с момента госпитализации в отделение на ангиографическом комплексе SIEMENS Artis Zee Floor в зависимости от риска неблагоприятных сердечно-сосудистых событий по шкале GRACE. Пациентам были установлены коронарные стенты с лекарственным покрытием Зотаролимус Resolute Integrity фирмы Medtronic.
Эхокардиографическое исследование проводилось после коронарного стентирования на 2–4-е сутки с момента госпитализации, на аппарате Toshiba Aplio 500 в соответствии с современными рекомендациями [9]. Толщину эпикардиальной жировой ткани визуализировали при положении пациента на левом боку из п...












