Эпидемиология и Инфекционные болезни. Актуальные вопросы №1 / 2016
Роль ожирения в развитии метаболических нарушений, прогрессировании фиброза печени и исходов противовирусной терапии у больных хроническим гепатитом С
1Ставропольский государственный медицинский университет Минздрава России; 2Центральный НИИ эпидемиологии Роспотребнадзора, Москва; 3Центр охраны здоровья семьи и репродукции Ставропольского краевого клинического консультативно-диагностического центра, Ставрополь
Цель исследования. Выявить влияние ожирения на метаболические параметры, прогрессирование фиброза у больных хроническим гепатитом С (ХГС) и исходы противовирусной терапии.
Материалы и методы. В исследование было включено 205 больных ХГС в возрасте от 18 до 69 лет. Проведен сравнительный анализ лабораторных показателей в группе больных ХГС с ожирением (n = 53) и без ожирения (n =152). Контрольную группу составили пациенты с ожирением (n = 44). Проведен анализ наличия инсулинорезистентности (ИР), метаболического синдрома, абдоминального ожирения в зависимости от индекса массы тела. На аппарате OMRON BF508 («Omron Healthcare Co., Ltd», Япония) определяли процент жировой ткани и висцерального жира в организме.
Результаты. У 53 (25,9%) больных ХГС с ожирением достоверно чаще наблюдали синдром ИР, стеатоз печени и более высокие индексы фиброза и гистологической активности. При сочетании ожирения с ИР чаще наблюдались метаболический синдром, цирроз печени и низкий ответ на противовирусную терапию. При увеличении уровня висцерального жира возрастал процент больных с ИР и другими компонентами метаболического синдрома, снижался процент ответа на противовирусную терапию.
Заключение. Ожирение у больных ХГС приводит к выраженным нарушениям метаболических параметров и низкому ответу на противовирусную терапию, достоверно чаще ассоциируется с циррозом печени.
В настоящее время значительное увеличивается количество пациентов с ожирением, а высокие темпы роста и широкая распространенность этой патологии позволяют говорить об ожирении как о новой «неинфекционной эпидемии». По данным ВОЗ, в 2008 г. более 1,7 млрд человек в возрасте 20 лет и старше имели избыточный вес, из них 25,0% (свыше 500 млн человек) страдали от ожирения. По прогнозам экспертов ВОЗ, к 2025 г. ожидается увеличение количества лиц с ожирением почти в 2 раза [1]. В России уже сейчас распространенность избыточной массы тела и ожирения составляет 46,5% среди мужчин и 51,7% среди женщин [2]. На фоне ожирения увеличивается риск сердечно-сосудистых заболеваний, сахарного диабета 2-го типа, синдрома обструктивного апноэ во сне и бесплодия. [3].
Ожирение способствует развитию неалкогольной жировой болезни печени (НАЖБП). У больных с ожирением стеатоз печени развивается в 95–100% случаев и трансформируется в стеатогепатит у 20–47% пациентов. Распространенность НАЖБП в странах Европы оценивают в 20–30% от общей популяции [4, 5]. Ведущая роль в патогенезе НАЖБП принадлежит нарушению углеводного и липидного обмена, а пусковым моментом в каскаде метаболических нарушений является инсулинорезистентность (ИР) [6, 7]. Первичная форма НАЖБП развивается на фоне метаболического синдрома или отдельных его компонентов. Вторичная форма НАЖБП наблюдается на фоне лекарственных поражений печени, синдрома избыточного бактериального роста, хирургических вмешательств на тонком кишечнике и при хроническом гепатите С (ХГС), который также широко распространен в популяции. У большинства пациентов ХГС протекает доброкачественно на протяжении длительного времени, и только у 20–30% он прогрессирует с формированием цирроза, печеночной недостаточности, портальной гипертензии и гепатоцеллюлярной карциномы. Сочетание ожирения с метаболическими нарушениями, включая ИР и сахарный диабет 2-го типа, играют роль в прогрессировании заболевания и увеличивают риск отсутствия ответа на противовирусную терапию ХГС [8].
Цель исследования – выявление влияния ожирения на метаболические параметры, прогрессирование фиброза у больных ХГС и исходы противовирусной терапии.
Материалы и методы
Были обследованы 205 больных ХГС с вирусом (НСV) генотипов 1 и 3 в возрасте от 18 до 69 лет, средний возраст 44,2 ± 10,3 года. Среди больных ХГС преобладали мужчины – 128 человек (62,4%) и больные с вирусом генотипа 1 – 123 человека (60,0%). Проведен сравнительный анализ лабораторных показателей в группе больных ХГС с ожирением (n = 53) и без ожирения (n = 152). Контрольную группу составили 44 пациента с ожирением. Группы были сопоставимы по полу, возрасту и индексу массы тела (ИМТ). Комбинированную противовирусную терапию [пегилированный интерферон-α-2а (ПегИФН-α-2а) или -α-2b (ПегИФН-α-2b) + рибавирин] получили 156 человек.
Оценку эффективности противовирусной терапии проводили на основании определения уровня РНК HCV после 4, 12 и 24 недель терапии при НСV генотипа 3, после 48 недель – при НСV генотипа 1, а также через 24 недели после ее окончания. Под устойчивым вирусологическим ответом (УВО) понимали отрицательный уровень РНК HCV в плазме крови через 24 недели после окончания противовирусной терапии.
Все пациенты подписали информированное согласие на участие в исследовании. Наблюдение проводилось в течение 2011–2014 гг. инфекционистом и эндокринологом в условиях кабинета амбулаторного приема Ставропольского краевого клинического консультативно-диагностического центра. Обследование проводили в соответствии с национальными рекомендациями по диагностике и лечению взрослых больных гепатитом С (2012–2013). Проведены клинические, антропометрические, биохимические, гормональные исследования. Для исключения гипотиреоза исследовали содержание тиреотропного гормона и свободного тиротоксина. Определяли содержание в крови кортизола, пролактина, лютеинизирующего и фолликулостимулирующего гормона, тестостерона. Определяли концентрации общего холестерина (ХС), триглицеридов (ТГ), ХС липопротеидов низкой (ЛПНП) и высокой плотности (ЛПВП) на автоматическом биохимическом анализаторе Konelab 30i («Thermo Scientific», Финляндия). Концентрацию инсулина (в мкЕД/ мл) устанавливали на микропланшетном ридере ELx800 («ФинБио», Финляндия). Для более точной оценки степени ИР использовали индекс HOMA (Homeostasis model assessment), определявшийся по уравнению:
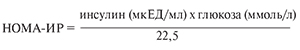
На наличие ИР указывают величины ≥ 2,77.
Тканевую чувствительность к инсулину определяли по индексу QUICKI (quantitative insulin sensitivity check index):
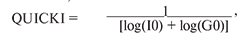
где I0 – инсулин в сыворотке крови натощак, G0 – глюкоза в сыворотке крови натощак.
Показатели 0,382 ± 0,007 расцениваются как норма, 0,331 ± 0,010 – как тканевая инсулиновая резистентность и 0,304 ± 0,007 – как сахарный диабет [9].<...












