STROKE №1 / 2017
Содержание липопротеина (А) и риск развития повторных сосудистых событий после первого ишемического инсульта
Center for Stroke Research Berlin (CSB), Klinik und Hochschulambulanz für Neurologie, Department of Biostatistics and Clinical Epidemiology, Charité–Universitätsmedizin Berlin, Germany; DZHK (German Center for Cardiovascular Research), Partner Site, Berlin, Germany; DZNE (German Center for Neurodegenerative Diseases), Partner Site, Berlin, Germany; Berlin Institute of Health (BIH), Germany.
Предпосылки и цель исследования. Связь между повышением уровня липопротеина (А) (ЛпА) и заболеваемостью сердечно-сосудистыми заболеваниями, в частности ишемической болезнью сердца и ишемическим инсультом (ИИ), хорошо известна. Однако данных
о связи между уровнями ЛпА и сосудистым риском у лиц, перенесших инсульт, нет. Цель настоящего исследования заключалась в определении риска развития повторных сердечно-сосудистых и цереброваскулярных событий у пациентов после впервые развившегося ИИ при повышении уровня ЛпА. Методы. Критериям включения в исследование соответствовали все пациенты с острым ИИ, принимавшие участие в проспективном исследовании C. Berlin и S. Study (Cream & Sugar) в период с января 2009 по август 2014 г., с имеющимися данными визуализации через 12 месяцев и сохранившимися образцами крови. Содержание ЛпА в сыворотке образцов крови определяли
с использованием метода нефелометрии, нечувствительного к изоформам. Мы оценили риск развития комбинированной сосудистой конечной точки в виде ИИ, транзиторной ишемической атаки, инфаркта миокарда, неселективной коронарной реваскуляризации и смерти от сердечно-сосудистых причин при повышении уровня ЛпА>30 мг/дл, при этом пороговое значение содержания ЛпА определили
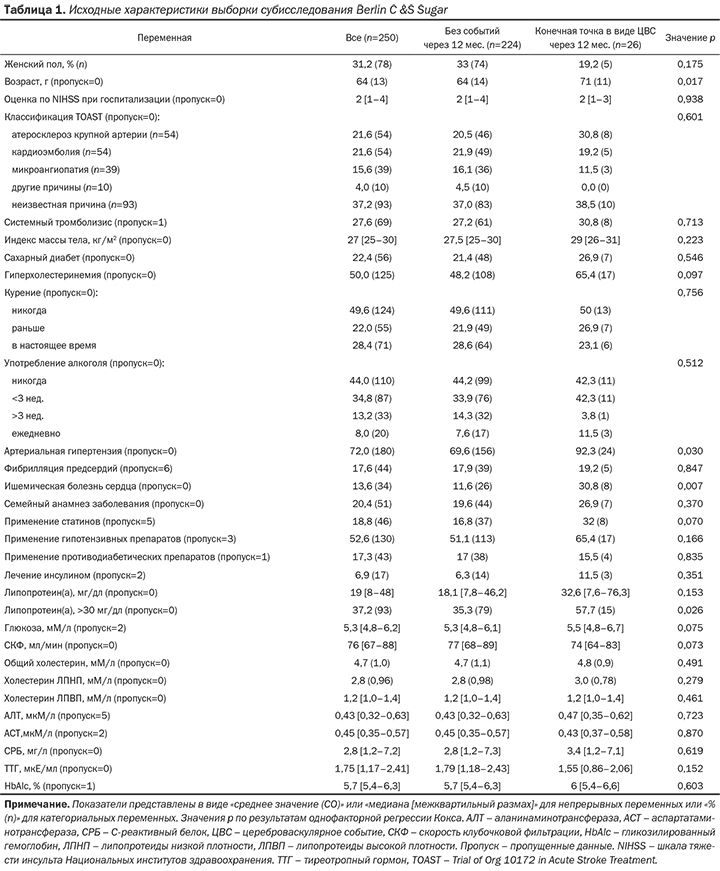
по результатам регрессионного анализа Кокса. Результаты. Из 465 участников исследования Cream & Sugar 250 пациентов с медианой оценки по шкале тяжести инсульта Национальных институтов здравоохранения в 2 балла (1–4 балла) включили в настоящее субисследование. Во время наблюдения у 26 (10%) пациентов зарегистрировали развитие повторных сосудистых событий. Среди пациентов
с нормальным содержанием ЛпА сосудистое событие произошло у 11 (7%) из 157 пациентов при медиане срока наблюдения 161 день (межквартильный размах 19–196 дней), в то время как среди пациентов с повышенным содержанием ЛпА у 15 (16%) из 93 пациентов событие развилось при медиане срока наблюдения 48 дней (межквартильный размах от 9 до 194 дней; р=0,026). После внесения поправок на потенциальные вмешивающиеся факторы риск развития повторного сосудистого события был значительно выше у пациентов
с повышенным содержанием ЛпА (отношение рисков 2,60; 95% доверительный интервал от 1,19 до 5,67; р=0,016). Выводы. У пациентов после впервые развившегося ИИ повышение содержания ЛпА ассоциировано с повышением риска развития комбинированного повторного сосудистого события. Этот вывод необходимо подтвердить результатами крупных многоцентровых исследований.
Инсульт является одной из наиболее распространенных причин смерти и инвалидизации во всем мире [1, 2]. К мероприятиям вторичной профилактики после ишемического инсульта (ИИ) относятся контроль установленных факторов риска, таких как артериальная гипертензия (АГ), фибрилляция предсердий, сахарный диабет и дислипидемия [3, 4]. Выявление основных факторов риска имеет большое значение для предотвращения развития повторных ишемических событий. Тем не менее у лиц, перенесших ИИ, сохраняется высокий риск развития повторных сосудистых событий и летального исхода [5, 6]. Другие маркеры, определение которых в крови обычно не проводят в клинической практике, могут играть важную роль в повышении сердечно-сосудистого риска.
Во многих крупных исследованиях изучали связь между повышением содержания липопротеина А (ЛпА) и риском развития сердечно-сосудистых заболеваний, включая ИИ. На сегодняшний день по результатам трех мета-анализов можно сделать вывод о повышении риска развития ИИ при высоком уровне ЛпА в сыворотке крови [7–9].
ЛпА состоит из липопротеида низкой плотности (ЛПНП), ковалентно связанного с аполипопротеином(А) (АпоА). Размер и содержание ЛпА в сыворотке крови в основном определяется полиморфизмом АпоА, гена LPA [10, 11]. Вариация числа копий в «kringle»-домене IV 2-го типа в пределах АпоА является причиной высокой гетерогенности молекулярной массы изоформ АпоА. Патогенетические механизмы, посредством которых ЛпА реализует свой проатерогенный, протромботический, антифибринолитический и воспалительный потенциалы, неизвестны, в то время как структурная гомология с плазминогеном была изучена [12–15].
Исследование Emerging Risk Factors Collaboration продемонстрировало наличие значительно более высокого риска развития первого нефатального инфаркта миокарда (ИМ), коронарной смерти или ИИ при повышении содержания ЛпА [7]. В отличие от этого фактических данных о влиянии уровня ЛпА на риск развития повторного сердечно-сосудистого события, особенно у пациентов после первого ИИ, не хватает. Только в двух проспективных исследованиях проводили оценку риска развития повторного ИИ у детей [16, 17]. В обоих исследованиях пришли к выводу, что повышение уровня ЛпА было ассоциировано с повышением риска развития повторного инсульта в 4–10 раз.
Цель настоящего исследования заключалась в изучении связи между повышением содержания ЛпА и развитием повторных сосудистых событий у взрослых пациентов после первого ИИ.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования и критерии отбора
Настоящее исследование представляет собой ретроспективный анализ данных исследования Berlin C&S Study (C&S – Cream&Sugar; NCT 01378468), продолжающегося в настоящее время проспективного когортного исследования, предназначенного для оценки прогностического значения результатов теста толерантности к триглицеридам у пациентов после острого ИИ. Дизайн исследования C&S был описан ранее [18]. Проводят скрининг всех пациентов в возрасте старше 18 лет с впервые развившимся острым ИИ, которые поступают на лечение в одну из трех университетских клиник Берлинского университета на предмет включения в исследование. Критерием наличия ИИ считают развитие очагового неврологического дефицита, сохраняющегося не менее 24 ч, без признаков кровоизлияния по результатам визуализации головного мозга. Развитие первого ИИ подтверждают соответствующими данными анамнеза. Исследование проводится в соответствии с Хельсинской декларацией и одобрено локальным комитетом по этике (EA4/100/08). Письменное информированное согласие было получено от всех пациентов до включения в исследование.
Исходные показатели
Регистрировали паспортные данные и отбирали образцы венозной крови натощак. Образцы крови натощак отбирали в 8 ч утра на 4-й день (межквартильный размах [МКР] 3–5-й день] после учетного события. Сыворотку отделяли путем центрифугирования в течение 30 мин и хранили при -80 °С в течение срока средней продолжительностью 2,7 года (стандартное отклонение [СО] 1,5 года). Кроме ЛпА все другие показатели оценивали в образцах свежей крови в Labor Berlin-Charite Vivantes GmbH. Эти исходные показатели изучали ферментативным путем в свежесобранных образцах венозной крови, используя анализатор Cobas 6000 (Roche/Hitachi). Содержание ЛпА определяли количественно, используя метод кинетической нефелометрии (Immage Immunchemie System, Beckmann Coulter) с поликлональным антителом к АпоА-домену ЛпА при проведении анализа, нечувствительного к изоформам АпоА.
Критерием наличия АГ считали уровень систолического артериального давления ≥140 мм рт.ст. или диастолического артериального давления ≥90 мм рт.ст., или указание пациента на применение гипотензивных препаратов. Критерием наличия гиперхолестеринемии считали содержание общего холестерина натощак ≥5,2 ммоль/л (≥200 мг/дл) или указание пациента на применение гиполипидемических препаратов до развит...












