Фарматека №14 (247) / 2012
Современные стратегии антиангинальной фармакотерапии хронической ишемической болезни сердца
ГБОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития России, Москва
Последние достижения молекулярной биологии атеросклероза раскрыли новое понимание патофизиологии коронарной болезни сердца, что позволило разработать новые методики терапии, нацеленные как на облегчение страданий больного, так и на модификацию течения этого заболевания. В настоящем обзоре представлена тактика проведения антиангинальной терапии пациентов с хронической ишемической болезнью сердца в аспекте, в первую очередь интересном практикующим врачам.
Сложности при стратификации риска как фактор, затрудняющий выбор терапии
Хорошо известно, что степень интенсивности превентивной медикаментозной терапии пациентов с ишемической болезнью сердца (ИБС) должна напрямую определяться уровнем сердечно-сосудистого риска. К сожалению, несмотря на множество разработанных для этой цели шкал, оценка риска для больных ИБС без острого инфаркта миокарда (ОИМ) в анамнезе сегодня сильно затруднена. В большинстве случаев существующие шкалы занижают степень риска для пациентов группы высокого риска и завышают – в группе низкого риска [1].
Наиболее значимой практической сложностью здесь представляется невозможность получения реальной информации о степени стабильности атеросклеротических бляшек в коронарных сосудах пациента с ИБС, обладающей первостепенной прогностической ценностью. По всей видимости, крупные, но имеющие плотную фиброзную покрышку атеросклеротические бляшки разрываются реже, но при этом обусловливают выраженную клиническую симптоматику (в частности, ангинозные боли). В то же время при их разрыве и высвобождении внутрь сосуда огромного количества прокоагулянтного тканевого фактора вероятно развитие тромботической окклюзии крупного сосуда, клиническим эквивалентом которого служит обширный инфаркт миокарда с формированием зубца Q [2].
Небольшие бляшки реже приводят к значимому снижению коронарного кровотока, что определяет более редкие и менее интенсивные приступы ангинозной боли. Но при этом бляшки небольшого размера могут быть значительно менее стабильными, эрозии или разрывы их тонкой фиброзной покрышки могут приводить к развитию ОИМ, как правило, без формирования зубца Q (рис. 1). В качестве наглядного примера можно привести истории болезни пациентов с плохо компенсируемым сахарным диабетом 2 типа, в анамнезе часто имеющих несколько мелкоочаговых инфарктов и эпизодов нестабильной стенокардии.
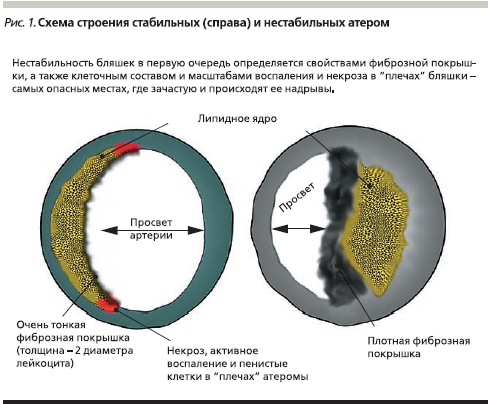
По новым данным, при нестабильной стенокардии внутри коронарных артерий возможно формирование своеобразного динамического равновесия, при котором в течение достаточно длительного времени на поверхности интимы происходят небольшие надрывы или образуются эрозии интимы, но формирования тромба удается избежать за счет активации антитромботической системы. Использование методов прямой визуализации структуры атером in vivo, таких как оптическая когерентная томография/спектроскопия, позволяет выявить такие бляшки [3].
В рамках данной концепции несложно объяснить результаты исследования COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation), в котором стентирование коронарных артерий не приводило к улучшению прогноза, но значительно улучшало клиническую симптоматику. По всей вероятности, несмотря на то что ангинозные боли у данных пациентов были связаны с крупными, с успехом стентированными бляшками, прогноз в данном случае определялся мелкими нестабильными бляшками, стентирования которых, по понятным причинам, не выполнялось.
Сегодня оценка степени стабильности атеросклеротических бляшек и вмешательства, направленные на их стабилизацию, в т. ч. через “упрочнение” фиброзной покрышки, становятся новой парадигмой превентивной кардиологии. По сути, все традиционные шкалы, разработанные для больных ИБС, решают задачу оценки риска посредством анализа факторов, опосредованно характеризующих именно стабильность атером.
Новые неинвазивные диагностические опции
Одним из основных направлений развития современной кардиологии является поиск минимально инвазивных методов прямой или косвенной оценки стабильности атеросклеротических бляшек, что позволит более точно предсказывать риск развития острого коронарного синдрома (ОКС). Их практическое применение представляется особенно важным при ведении пациентов со средним риском, выбор оптимального лечения которых часто затруднен. Сегодня на Западе с этой целью наиболее широко используется такой интегральный показатель масштаба поражения коронарного русла, как кальциевый индекс, который рассчитывается при проведении мультиспиральной компьютерной томографии (МСКТ) [4].
Другим подходом, который также может быть реализован при проведении МСКТ, служит оценка распределения плотности контраста в коронарном русле, что позволяет определять участки коронарных артерий с низким напряжением сдвига, где ожидаемо могут формироваться нестабильные атеромы [5].
Сегодня появляется все больше экспериментальных неинвазивных методик, призванных фокусно определять состояние атеросклеротических бляшек.
К ним относятся следующие методы диагностики:
• МР-визуализация с применением внутрисосудистых катушек и новых контрастов (например, ультрамалых частиц оксида железа, которые накапливаются макрофагами);
• совмещенные технологии МСКТ/МРТ (магнитно-резонансная томография), ПЭТ/КТ (позитронно-эмиссионная томография/компьютерная томография), КТ/сцинтиграфия;
• молекулярная лучевая диагностика (например, сцинтиграфия с 99Tc-аннексином 5, 99Tc-IL-2, с меченными тромбоцитами и лип...












