Терапия №6 / 2016
Сравнительная оценка хронической перегрузки железом при применении препаратов железа в субтоксических дозах
ФГБОУ ВО «Ивановская государственная медицинская академия», 1 кафедра фармакологии и клинической фармакологии,
2 научно-исследовательский центр, 4 кафедры химии, г. Иваново
3 ФГБОУ ВО «Московский физико-технический институт (государственный университет)», кафедра интеллектуальных систем,
г. Долгопрудный
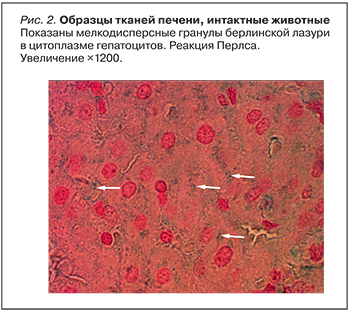
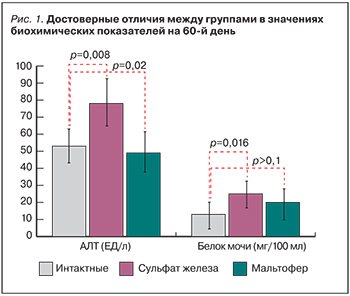
Используемые для терапии железодефицитной анемии препараты железа отличаются различной безопасностью. В отличие от органических солей железа такие неорганические соединения железа, как оксиды, гидроксиды и сульфаты не обладают высокой биодоступностью и существенно увеличивают нагрузку тканей нерастворимыми окислами железа. В настоящей работе проведено экспериментальное исследование препаратов железа на основе гидроксида железа в составе полимальтозного комплекса (Мальтофер®) и сульфата железа. Пероральный прием сульфата железа в течение 2 мес вызывал хроническую перегрузку железом (системный гемосидероз), проявляющуюся как гистологическим повреждением гемосидерином паренхимы печени, почек и головного мозга, так и повышением уровня аланинаминотрансферазы в крови и уровней белка в моче. По сравнению с сульфатом железа Мальтофер имеет преимущества при длительном применении: отсутствовали отложения гемосидерина в тканях почек и мозга; в печени небольшие отложения гемосидерина были отмечены только во внутридольковых синусовых капиллярах, но не в гепатоцитах.
Анемия устанавливается при концентрации гемоглобина менее 120 г/л у небеременных женщин и менее 130 г/л у мужчин. По данным Всемирной организации здравоохранения, анемией страдают 2 млрд жителей Земли, 80–90% этих состояний связано с дефицитом железа (железодефицитные синдромы), а более половины является железодефицитной анемией (ЖДА) [11]. В России, по данным Минздрава, анемией страдает 15% населения [1, 2].
 Для лечения ЖДА назначают препараты, содержащие железо, – органические соли (фумарат железа и др.), неорганические соли (в частности, сульфат железа, т.н. железный купорос), полимальтозные комплексы с гидроксидами железа и др. В то же время в последние десятилетия сложилась практика долговременного приема (месяцы и годы) многокомпонентных комплексов микронутриентов, содержащих сульфат железа. Можно сказать, что ЖДА настолько напугала врачей, что возникла своего рода мания поголовного назначения комплексов микронутриентов (содержащих, как правило, сульфат железа) с целью профилактики несуществующей ЖДА [3, 4].
Для лечения ЖДА назначают препараты, содержащие железо, – органические соли (фумарат железа и др.), неорганические соли (в частности, сульфат железа, т.н. железный купорос), полимальтозные комплексы с гидроксидами железа и др. В то же время в последние десятилетия сложилась практика долговременного приема (месяцы и годы) многокомпонентных комплексов микронутриентов, содержащих сульфат железа. Можно сказать, что ЖДА настолько напугала врачей, что возникла своего рода мания поголовного назначения комплексов микронутриентов (содержащих, как правило, сульфат железа) с целью профилактики несуществующей ЖДА [3, 4].
Однако из клинической практики хорошо известно, что железосодержащие препараты (сульфат железа) могут вызывать различные побочные эффекты – запоры или, наоборот, диарею, боли в эпигастрии, тошноту, рвоту, иногда нарушение функции печени [5]. Двухвалентное железо (Fe2+) в составе сульфата железа легко окисляется до прооксидантного трехвалентного железа (Fe3+), которое, распространяясь по организму, способствует усиленному формированию гемосидероза (т.е. нефизиологических и нерастворимых отложений окислов железа в тканях, т.н. гемосидерина) [6]. Гемосидероз поражает органы в следующей последовательности: печень, миокард, скелетная мускулатура, почки, мозг, органы зрения, суставы [7]. Таким образом, печень страдает от гемосидероза в первую очередь. В норме печень – это депо железа, в котором оно сохраняется в форме плотно упакованных ферритиновых гранул, исключающих контакт ионов Fe2+ с окисляющими агентами и c мембранами гепатоцитов.
При использовании неорганических форм железа, ионы Fe2+ окисляются до Fe3+ с образованием гемосидерина – темно-желтого пигмента, включающего смесь окислов железа с денатурированными белками. Денатурированные белки активируют аутоиммунные реакции, что наряду с прооксидантными свойствами трехвалентного железа поддерживает хроническое воспаление, вызывает повреждения паренхимы печени и замещения ее дисфункциональной фиброзной тканью. Чрезмерное накопление железа в печени в форме гемосидерина существенно замедляет процесс регенерации печени, что провоцирует развитие цирроза печени и поражение других органов (сердца, почек, мозга и др.) [5, 7].
Цель исследования: сравнительная оценка развития хронической перегрузки железом при длительном применении препаратов на основе сульфата железа и на основе полимальтозного комплекса железа.