STROKE №3 / 2017
Связь между антиагрегантной терапией и исходами после внутримозгового кровоизлияния
Department of Neurology, Southern Illinois University School of Medicine, Springfield; Department of Emergency Medicine, Department of Neurology, Massachusetts General Hospital, and Brigham and Women’s Hospital Heart and Vascular Center, Harvard Medical School, Boston; Duke Clinical Research Institute, Durham, NC; Department of Medicine, Department of Neurology, Duke University Medical Center, Durham, NC; Department of Biostatistics and Bioinformatics, Duke University, Durham, NC; Department of Medicine, Stanford University School of Medicine, CA; Department of Medicine, Ronald-Reagan UCLA Medical Center; Department of Clinical Neurosciences, Hotchkiss Brain Institute, Cumming School of Medicine, University of Calgary, Alberta, Canada.
Предпосылки и цель исследования. Несмотря на известную связь между приемом антиагрегантов (ААТ – антиагрегантная терапия) и риском развития внутримозгового кровоизлияния (ВМК), данных о связи между ААТ до инсульта и исходами, особенно в отношении пациентов, получавших комбинированную ААТ (кААТ), мало. Мы предположили, что прием антиагрегантов до инсульта ассоциирован
с повышением уровня летальности при ВМК. Методы. Проанализировали данные 82 576 пациентов с ВМК, не получавших пероральных антикоагулянтов, проходивших лечение в период с октября 2012 по март 2016 г. в 1574 клиниках, участвующих в программе Get with the Guidelines-Stroke. Пациентов разделили на группы отсутствия ААТ, монотерапии ААТ (мААТ) и кААТ до поступления в клинику по поводу ВМК. Мы описали исходные характеристики пациентов, наличие сопутствующих заболеваний, характеристики клиник и исходы в целом
и после стратификации в зависимости от статуса применения ААТ. Результаты. До развития ВМК 65,8% пациентов не получали ААТ, 29,5% пациентов получали мААТ и 4,8% пациентов были на кААТ. В группе ААТ отметили общее умеренное повышение уровня внутрибольничной летальности по сравнению с пациентами группы без ААТ (24 vs 23%; скорректированное отношение шансов [ОШ]=1,05; 95% доверительный интервал [ДИ] от 1,01 до 1,10). Пациенты, получавшие мААТ и кААТ, были старше и имели более высокие профили риска, с точки зрения наличия сопутствующих заболеваний, но существенных различий в показателях внутрибольничной летальности среди пациентов на мААТ по сравнению с пациентами, не получавшими ААТ, не было (23 vs 23%, скорректированное ОШ=1,01, 95% ДИ от 0,97 до 1,05). Тем не менее уровень внутрибольничной летальности был выше среди пациентов на кААТ по сравнению с пациентами, не получавшими
в стационаре.
Тромбоциты необходимы для нормальной работы системы гемостаза. Они прикрепляются к поврежденному участку сосудистой стенки, агрегируют и участвуют в восстановлении стенки сосуда. Однако при отсутствии контроля этот процесс может привести к образованию тромбов, окклюзии сосудов, появлению или прогрессированию атеросклероза [1].
По этой причине частота назначения антиагрегантной терапии (ААТ) пациентам с инсультом и заболеваниями сердца высока [2]. Также повысилась частота использования новых антиагрегантов и двойной ААТ у пациентов с инфарктом миокарда и после стентирования артерий [3, 4].
Несмотря на высокую эффективность ААТ в рамках первичной или вторичной профилактики при ишемической болезни сердца и инсульте, у пациентов, получающих ААТ, повышен риск развития внутримозгового кровоизлияния (ВМК), которое часто бывает фатальным [5, 6]. Пациенты, у которых развивается спонтанное ВМК, чаще получают ААТ, чем антикоагулянтную терапию [7]. В исследованиях, посвященных анализу связи факта приема ААТ и исходов ВМК, получили противоречивые результаты, возможно, отражающие различия в размерах выборок, демографических характеристиках, методологии и методах статистического анализа [8]. По данным ранее проведенного комплексного мета-анализа, уровень внутрибольничной летальности у пациентов, получавших ААТ до развития ВМК, был выше [8]. Этот эффект, предположительно, связан с увеличением размера гематомы на фоне дисфункции тромбоцитов с последующим развитием летального исхода или инвалидности [9–11].
Цель нашего исследования заключалась в изучении результатов применения ААТ у пациентов с ВМК в реальных условиях. При этом использовали набор данных реестра Get with the Guidelines (GWTG)-Stroke. Мы также сравнили исходы у пациентов, получавших монотерапию ААТ (мААТ) и комбинированную ААТ (кААТ), и изучили тенденцию в частоте назначения ААТ при выписке у пациентов с ВМК.
МЕТОДЫ
Источник данных
GWTG-Stroke – продолжающийся добровольный непрерывный реестр данных пациентов и инициатива по улучшению оказания медицинской помощи при инсульте. Методы сбора данных и определения, используемые в реестре GWTG-Stroke, были подробно описаны ранее [12, 13]. Компания Quintiles Company (Кембридж, Массачусетс) является клинической исследовательской организацией, а анализ данных проводит научно-исследовательский институт Дюка (Дарем, Северная Каролина). В реестре подразумевается деидентификация данных на уровне отбора пациентов в участвующих в инициативе клиниках с соблюдением локальных нормативов и законов о неприкосновенности частной жизни и получением одобрения локальных советов по этике в случае необходимости. Комитет по этике Университета Дюка одобрил проведение анализа данных научно-исследовательским институтом Дюка.
Выборка исследования
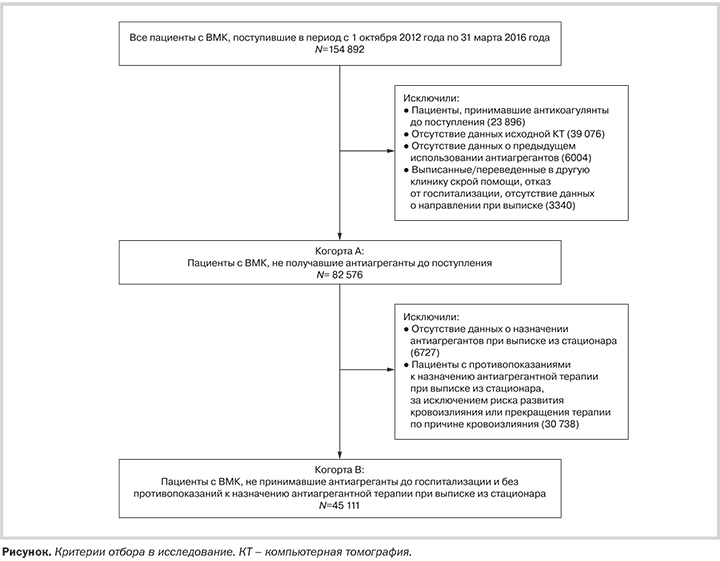
Данные всех пациентов с диагнозом ВМК извлекли из базы данных реестра GWTG-Stroke. В исследование отбирали данные за период с 1 октября 2012 до 31 марта 2016 г. Данные об использовании ААТ до развития ВМК регистрировали как составную часть традиционного лечения, и критерием проведения ААТ считали прием любого антиагреганта в течение 7 дней до госпитализации. Из 154 892 пациентов исключили 23 896 человек, принимавших антикоагулянты до госпитализации, 39 075 пациентов исключили из-за отсутствия данных исходной компьютерной томографии, 6004 пациентов исключили по причине отсутствия данных о проведении ААТ на момент госпитализации. Кроме того, исключили 3340 пациентов из-за отсутствия данных о направлении при выписке, из-за перевода в другое лечебное учреждение или отказа от госпитализации. Для проведения анализа данных окончательную выборку исследования разделили на 2 когорты (см. рисунок). В когорту А включили всех пациентов, соответствующих вышеописанным критериям (82 576 пациентов из 1574 клиник), и данные этих пациентов использовали для анализа исходов, связанных с проведением ААТ. В когорту В включили всех пациентов из когорты А, за исключением тех, у кого не было данных о назначении ААТ при выписке (6727 пациентов), или которым не назначили ААТ при выписке из-за наличия противопоказаний или отказа от такой терапии со стороны пациента или его родственников (30 738 пациентов). Конкретные причины от отказа/противопоказания для назначения ААТ при выписке описаны в таблице I в дополнительных данных on-line. Данные пациентов из когорты В использовали для изучения тенденции частоты назначения ААТ пациентам с ВМК при выписке (45 111 пациентов из 1431 клиники).
Статистический анализ
Мы описали исходные характеристики пациентов, регистрировали сопутствующие заболевания, характеристики клиник и исходы в целом и в зависимости от применения ААТ, используя доли для описания категориальных переменных и средние значения со стандартным отклонением (СО) для непрерывных переменных. Различия в этих характеристиках выявляли с помощью стандартизован...