Акушерство и Гинекология №11 / 2018
Тканеинженерная конструкция на основе полидиоксанона и мультипотентных стромальных клеток для пластики дефектов брюшной полости и дна малого таза
1 ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва;
2 ФГБНУ Научно-исследовательский институт морфологии человека, Москва, Россия;
3 ГНУ Институт порошковой металлургии, Минск, Беларусь;
4 ФГАОУ ВО Российский университет дружбы народов, Москва
Цель исследования. Изучение безопасности и эффективности трансплантации разработанного тканеинженерного протеза на основе полидиоксанона и культуры мультипотентных стромальных клеток (МСК) пупочного канатика.
Материал и методы. Оценку биосовместимости протезов in vivo проводили на беспородных крысах путем моделирования полнослойного дефекта передней брюшной стенки, к краям которого подшивали полидиоксаноновый протез, незаселенный или заселенный культурой клеток. В качестве группы сравнения использовали протез на основе децеллюляризированной дермы (Permacol). Животных выводили из эксперимента на 3, 10, 30, 60 и 180 сутки после операции. Проводили макроскопическое, тензиометрическое, гисто-морфометрическое, иммуногистохимическое исследования.
Результаты. Протезы на основе полидиоксанона более эффективно интегрировались и прорастали собственными тканями. Биомеханические свойства тканей в области трансплантации на отдаленных сроках не отличались между группами и нативной тканью передней брюшной стенки. При трансплантации тканеинженерной конструкции наблюдали меньшую степень выраженности воспалительной реакции за счет поляризации макрофагов в М2-направлении и более выраженный ангиогенез. Трансплантированные клетки не дифференцировались в клетки кровеносных сосудов и тотально элиминировались макрофагами реципиента. По-видимому, регистрируемые эффекты реализовались за счет паракринных механизмов.
Заключение. Благодаря добавлению в состав протеза культуры МСК удалось существенно снизить степень выраженности воспалительной реакции отторжения инородного тела, стимулировать ангиогенез и скорость замещения собственными тканями реципиента.
Применение полностью резорбируемых биологических протезов становится все более частым выбором хирургов при герниопластических операциях и укреплении мягких тканей дна малого таза [1]. Несмотря на высокую стоимость, биологические протезы на основе децеллюляризированных тканей животных (Пермакол) и человека (Alloderm) все чаще применяются, в особенности, в педиатрической практике, например, при диафрагмальных грыжах новорожденных, в связи с тем, что протез постепенно замещается собственными тканями и может «расти» вместе с тканями ребенка [2]. Полная резорбция протеза и замещение его собственными тканями должны устранить возможные причины большинства mesh-ассоциированных осложнений по принципу «нет протеза – нет осложнений» [3].
К сожалению, частота рецидивов при пластике биологическими протезами не отличается от операций с применением синтетических протезов [4], а в некоторых исследованиях даже превышает их [5]. Это может быть связано с тем, что скорость резорбции протеза превышает скорость замещения его собственными тканями, что приводит к непрочной краевой интеграции протеза [4]. Существует два основных подхода к решению данной проблемы. Первый – это использование более длительно резорбируемых синтетических материалов для производства протезов. Среди длительно резорбируемых полимеров для разработки хирургических протезов и скаффолдов для тканевой инженерии внимание исследователей привлекают поликапролактон [6], полидиоксанон [3], триметиленкарбонат [7, 8] и поли-4- гидроксибутират [9].
Второй подход заключается в добавлении к материалу протеза биологически активных веществ, которые обеспечивают ускорение замещения материала протеза собственными тканями. Экспериментально и клинически апробированы технологии импрегнации рекомбинантных факторов роста (например, FGF, BMP, VEGF и др.), релизинг которых стимулирует ангиогенез и регенерацию в области трансплантации [10, 11]. Перспективным способом, стимулирующим регенерацию, является добавление в структуру протеза мультипотентных стромальных клеток (МСК), которые являются клеточным субстратом для замещения области трансплантации соединительной тканью, за счет паракринных факторов стимулируют ангиогенез и регенерацию, а, кроме того, должны повышать биосовместимость протезов, подавляя реакцию на инородное тело [12]. В данной работе мы изучили влияние МСК на биосовместимость и функциональные свойства сетчатого протеза на основе полидиоксанона на экспериментальной модели полнослойного дефекта передней брюшной стенки у крыс.
Материалы и методы
Экспериментальные образцы сетчатых протезов
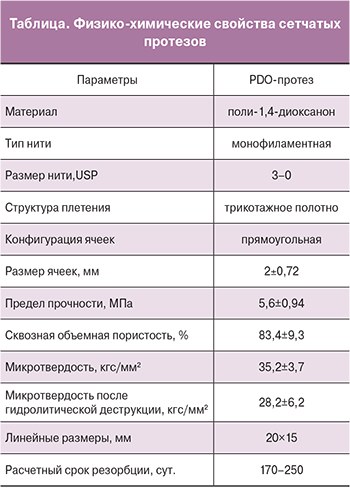
Образцы сетчатых протезов были изготовлены на основе монофиламентых полидиоксаноновых (PDO) нитей 3-0 (USP). Пористость сеток определяли методом низкотемпературной адсорбции азота с использованием анализатора удельной поверхности SA 3100 (Beckman Coulter) по стандартной методике. Микротвердость нитей измеряли на атомно-силовом микроскопе ICON (Bruker) до и после гидролитической деструкции в растворе Na2HPO4×2H2O (рН=7,32) в течение 30 суток.
Культура МСК
В качестве клеточного компонента тканеинженерной конструкции (ТИК) использовали МСК пупочного канатика крысы. Первичные культуры выделяли из интерваскулярной стромы пуповины методом эксплантатов. Принадлежность клеток к МСК подтверждали, оценивая их способность к клоногенному росту на поверхности необработанной культуральной подложки, экспрессию специфических поверхностных антигенов и возможность ответа на действие индукторов дифференцировки в адипогенном, остеогенном и хондрогенном направлениях [13].
Создание ТИК на основе сетчатого PDO-носителя и МСК пупочного канатика
МСК пупочного канатика крысы метили витальным трейсером PKH26 Red Fluorescent Cell Linker Kit (Sigma-Aldrich), дважды отмывали 0,9% раствором хлорида натрия и ресуспендировали в культуральной среде до конечной концентрации 0,5×106 кл/мл. Сетчатый носитель переносили в пробирку-биореактор (SPL Lifesciences) и добавляли 5 мл клеточной суспензии. Заселение носителя проводили ротационным методом с помощью орбитального шейкера OS-20 (Biosan) (режим вращения платформы 75 об/мин) при стандартных культуральных условиях в течение 24 часов. Эффективность заселения носителя клетками оценивали с помощью флуоресцентной микроскопии.
 Сканирующая электронная микроскопия
Сканирующая электронная микроскопия
Образцы фиксировали 2,5% глутаровым альдегидом (Sigma-Aldrich), инкубировали в 1% растворе осмия (Sigma-Aldrich) и обезвоживали в восходящих спиртах. После высушивания на воздухе в течение 24 часов образцы покрывали слоем золота с помощью вакуумной напылительной установки (Eiko), приклеивали к столику электропроводящим серебряным клеем Dotite (Fujikura Kasei) и исследовали с помощью СЭМ S-500 (Hitachi).
Экспериментальная модель дефекта передней брюшной стенки
При постановке ...












