Акушерство и Гинекология №6 / 2025
Влияние эндогенного тестостерона на здоровье и качество жизни у женщин в постменопаузе
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия.
Согласно статистическим прогнозам, к 2050 г. 30% мирового населения достигнут возраста 65 лет и более. Увеличение продолжительности жизни сопровождается ростом числа лет, прожитых с хроническими и возраст-ассоциированными заболеваниями. У женщин в постменопаузе на фоне эстрогенодефицита возрастает риск развития ожирения, инсулинорезистентности, сахарного диабета 2 типа, сердечно-сосудистых осложнений. Роль андрогенов в развитии возраст-ассоциированных заболеваний до недавнего времени оставалась неопределенной. Последние литературные данные свидетельствуют о том, что эндогенные андрогены оказывают протективные эффекты на сердечно-сосудистую систему, когнитивные функции, костно-мышечную систему и либидо у женщин в постменопаузе. В связи с этим важно рационально подбирать менопаузальную гормонотерапию с учетом сохранения физиологического уровня эндогенных гормонов, в том числе андрогенов.
Заключение: При ведении женщин в постменопаузе ключевым аспектом становится персонализированный подход, учитывающий индивидуальные особенности пациентки. Менопаузальная гормональная терапия, не подавляющая продукцию эндогенных андрогенов, в комплексе с коррекцией образа жизни – ключ к здоровому долголетию и улучшению качества жизни женщин в постменопаузе.
Вклад авторов: Ермакова Е.И., Сметник А.А. – концепция и дизайн, сбор и обработка материала, написание текста, редактирование.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование не имело спонсорской поддержки.
Для цитирования: Ермакова Е.И., Сметник А.А. Влияние эндогенного тестостерона на
здоровье и качество жизни у женщин в постменопаузе.
Акушерство и гинекология. 2025; 6: 74-82
https://dx.doi.org/10.18565/aig.2025.161
Проблемы здоровья и качества жизни женщин в пери- и постменопаузе в последние десятилетия приобретают особое приоритетное значение в связи с увеличением продолжительности жизни во всем мире. За период с 1950 по 2017 гг. средняя продолжительность жизни женщин увеличилась более чем на 22 года: с 52,9 года в 1950 г. до 75,6 года в 2017 г., а в настоящее время этот показатель приближается к 80 годам [1]. Согласно статистическим прогнозам, к 2050 г. 30% мирового населения достигнут возраста 65 лет и более [2].
Долголетие сопровождается увеличением количества лет, прожитых с хроническими болезнями и инвалидностью. У женщин в постменопаузе значимо повышается риск развития ожирения, инсулинорезистентности, сахарного диабета 2 типа (СД2), когнитивных нарушений, деменции, остеопороза. Наступление менопаузы четко ассоциировано с увеличением риска сердечно-сосудистых заболеваний (ССЗ). Ишемическая болезнь сердца, сердечная недостаточность и инсульт являются ведущими причинами смерти женщин в возрасте 60 лет и старше во всем мире [3]. Понимание факторов, которые поддерживают здоровье и активность женщин с возрастом, жизненно важно, учитывая, что средняя продолжительность жизни девочки, родившейся в 2030 г., вероятно, превысит 90 лет [4]. Считается, что половые гормоны играют решающую роль в развитии болезней старения, при этом у женщин основное внимание уделяется эстрогенам. Значение андрогенов в патогенезе ССЗ и других возрастных изменений до недавнего времени оставалось неопределенным, хотя имеющиеся литературные данные свидетельствуют о том, что эндогенный тестостерон оказывает протективные эффекты на здоровье женщин в постменопаузе.
Синтез и физиологические свойства андрогенов в женском организме
По химической структуре андрогены представляют собой 19-углеродные стероидные гормоны, в основе которых лежит скелет молекулы углеводорода сложного строения – андростана. Основным андрогеном как у мужчин, так и у женщин является тестостерон, который вырабатывается в гонадах или в периферических тканях из прогормонов: дегидроэпиандростерона (ДГЭА) и андростендиона [5]. ДГЭА – полифункциональный стероидный гормон, большая часть которого (80%) продуцируется сетчатой зоной надпочечников. В надпочечниках ДГЭА метаболизируется с образованием андростендиола, андростендиона, а также дегидроэпиандростерон-сульфата (ДГЭА-C) [6]. Неактивная форма ДГЭА-C попадает в плазму крови и в периферических тканях с помощью интракринных механизмов метаболизируется с образованием активных форм андрогенов и эстрогенов [6]. В настоящее время идентифицировано более 30 тканеспецифичных генов/ферментов, регулирующих как внутриклеточное образование, так и инактивацию половых стероидов в соответствии с конкретными потребностями органа или ткани [7]. Ферменты глюкуронилтрансферазы и сульфотрансферазы инактивируют внутриклеточно андрогены и эстрогены, таким образом поддерживая уровни активных половых стероидов в сыворотке крови в пределах низких концентраций, что особенно важно для периода постменопаузы [7].
Андростендион – андрогенный стероид, вырабатывается яичниками и корой надпочечников у женщин. Во внегонадных тканях-мишенях, таких как мозг, кости, жировая ткань, кожа, происходит конверсия андростендиона путем ароматизации в эстрон либо под воздействием фермента 17β-гидроксистероиддегидрогеназы – в тестостерон. В свою очередь, тестостерон преобразуется в эстрадиол под влиянием ароматазы или в дигидротестостерон (ДГТ) при участии 5α-редуктазы [6, 7]. Чувствительность тканей к андрогенам варьирует в зависимости от активности тканевых рецепторов к андрогенам, а также от количества и активности ферментов 5α-редуктазы и ароматазы, которые могут значительно различаться у разных женщин (рис. 1).
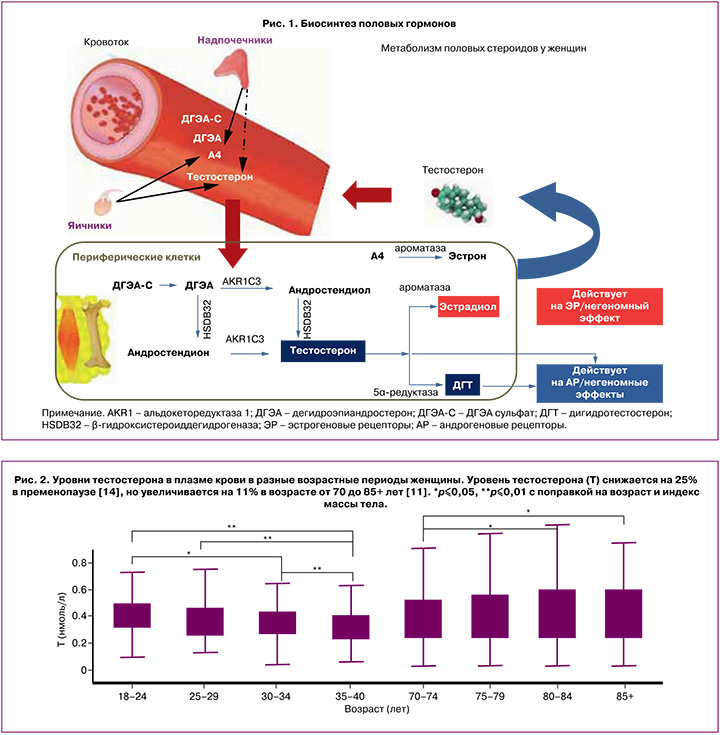
Примерно две трети тестостерона в крови связано с глобулином, связывающим половые гормоны (ГСПГ), почти треть слабо связана с альбумином и другими белками плазмы, и лишь незначительное количество циркулирует в свободном состоянии [8]. Показано, что несвязанный тестостерон является наиболее легко разлагаемой фракцией и, следовательно, наименее метаболически активной [9]. Кроме того, измерение уровня несвязанного тестостерона осложняется низкой точностью и специфичностью большинства методов, а формулы, используемые для расчета свободной фракции, недостаточно достоверны и дают противоречивые результаты [8]. В связи с этим международная комиссия пришла к выводу, что определение уровня общего тестостерона остается наиболее оптимальным методом для оценки функциональной а...












