Акушерство и Гинекология №8 / 2024
Влияние иммуномодулирующей терапии на репродуктивную функцию у пациенток с бесплодием, обусловленным хроническим эндометритом
1) ГБУЗ Тюменской области «Перинатальный центр», Тюмень, Россия;
2) ФГБОУ ВО «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Тюмень, Россия;
3) ЧОУ ДПО «Академия медицинского образования имени Ф.И. Иноземцева», Санкт-Петербург, Россия
Комплекс антимикробных пептидов и цитокинов оказывает положительное действие на иммунитет, экспрессию рецепторов прогестерона, ангиогенез и способствует повышению частоты беременностей и живорождений у пациенток с бесплодием и хроническим эндометритом (ХЭ). Нерешенным остается вопрос о количестве курсов лечения для получения наибольшего эффекта.
Цель: Сравнить эффективность комплексного лечения в прегравидарном периоде пациенток с бесплодием, обусловленным ХЭ, в достижении спонтанной беременности и живорождения с использованием препарата «Суперлимф» одним и двумя курсами.
Материалы и методы: Пациентки I группы (n=303) применяли Суперлимф 25 ЕД одним курcом (20 дней), II группы (n=303) – двумя курсами с перерывом 1–1,5 месяца; кроме того, все пациентки получали один курс антибактериальной терапии и гестаген циклически. Использовали клинические и лабораторные исследования.
Результаты: Частота наступления беременности в течение 6 месяцев после лечения составила 52,2 и 63,4% в I и II группах соответственно, р=0,05, с максимальной разницей в первый месяц после окончания лечения – 15,5% против 31,4% соответственно, р<0,001 (ОР=2,02; 95% ДИ 1,48–2,75), то есть была выше в 2 раза во II группе по сравнению с I. Частота живорождений составила 43,2 и 57,8%, р=0,05, с максимальной разницей при наступлении беременности в первый месяц после окончания лечения – 11,9% против 28,1% соответственно, р<0,001 (ОР=2,36; 95% ДИ 1,65–3,37). Риск выкидышей и преждевременных родов был в 2 раза ниже при приеме двух курсов Суперлимфа.
Заключение: Лечение ХЭ с использованием препарата «Суперлимф» в прегравидарном периоде двумя курсами по 20 дней с перерывом 1–1,5 месяца увеличивает шансы наступления спонтанной беременности на 22%, живорождений – на 34% и способствует снижению риска выкидышей и преждевременных родов в 2 раза по сравнению с применением одного курса.
Вклад авторов: Дикке Г.Б. – разработка концепции, дизайна и программы исследования, анализ результатов статистической обработки клинического материала и их интерпретация, поиск литературных источников, написание статьи, редактирование, руководство в ходе исследования; Суханов А.А. – сбор клинического материала, формирование электронной базы данных, ее подготовка для анализа; Кукарская И.И. – организация исследования на клинической базе, проверка электронной базы данных на готовность к анализу.
Конфликт интересов: Авторы сообщают об отсутствии конфликта интересов и гарантируют, что статья является оригинальной работой авторов.
Финансирование: ООО «Биотехфарм», Москва, Россия (предоставило образцы препарата «Суперлимф»).
Одобрение Этического комитета: Исследование было одобрено локальным Этическим комитетом ГБУЗ ТО «Перинатальный центр» (Тюмень, Россия).
Согласие пациентов на публикацию: Пациенты подписали информированное согласие на публикацию своих данных.
Обмен исследовательскими данными: Данные, подтверждающие выводы этого исследования, доступны по запросу у автора, ответственного за переписку, после одобрения ведущим исследователем.
Для цитирования: Суханов А.А., Дикке Г.Б., Кукарская И.И. Влияние иммуномодулирующей терапии
на репродуктивную функцию у пациенток с бесплодием, обусловленным хроническим эндометритом.
Акушерство и гинекология. 2024; 8: 141-152
https://dx.doi.org/10.18565/aig.2024.204
В последние годы в научной литературе активно обсуждается вопрос о роли иммунной системы в репродукции. Уже не вызывает сомнений, что хроническое воспаление в эндометрии вызвано сдвигами в клеточном звене локальной иммунной системы, что приводит к «переключению» иммунных механизмов, обеспечивающих толерантность, необходимую для имплантации и продолжения беременности, на поддержание воспалительной реакции, направленной на эрадикацию инфектов. Но если роль антибактериальной терапии (АБТ) в лечении хронического эндометрита (ХЭ) доказана и не оспаривается, то сведения о необходимости и эффективности применения иммуномодулирующей терапии еще накапливаются. На сегодняшний день имеется потребность в предварительной оценке полученных знаний и определении возможностей иммуномодулирующей терапии в восстановлении фертильности у пациенток с ХЭ.
Поиск зарубежных литературных источников проводился в международных базах публикаций PubMed, Google Scholar, Cochrane Library, русскоязычных – в поисковой системе e-Library с глубиной поиска 10 лет (2015–2024 гг.). По ключевым словам chronic endometritis, infertility, immunity было найдено 454 и 865 статей соответственно, из которых в обзор были включены работы, удовлетворявшие критериям включения (систематические обзоры и метаанализы, рандомизированные контролируемые и когортные исследования) – всего 50 работ. Далее приведены результаты когортного клинического исследования, выполненного с целью определения оптимальной продолжительности лечения с использованием комплекса экзогенных антимикробных пептидов и цитокинов для восстановления фертильности у пациенток с ХЭ.
Роль иммунной системы в репродукции
Известно, что процесс имплантации зависит от двух основных факторов: качества эмбриона и рецептивности эндометрия. Взаимодействие между эмбрионом и эндометрием, а также баланс между ними и иммунной системой имеют важное значение для успешной имплантации [1, 2].
Имплантация – эволюционно консервативная воспалительная реакция, включающая воспалительные факторы, необходимые для нидации эмбриона в эндометриальную ткань, что обеспечивается накоплением Т-лимфоцитов и макрофагов в эпителии матки [3]. Затем воспалительная реакция переходит в противовоспалительную, включающую подавление местной иммунной активности и защиту трофобласта. Этот процесс обеспечивается клетками uNK (натуральные киллеры матки), которые рекрутируются половыми гормонами и цитокинами (ЦК) – интерлейкинами (ИЛ)-11 и ИЛ-15, накапливающимися в месте воспаления [4]. Другими словами, изначально присутствие лимфоцитов смещает иммунологические реакции в сторону ответа Т-хелперов (Th)-1 и Th-17 (провоспалительные), впоследствии доминирование Th-2 (противовоспалительные) и их ЦК подавляет воспаление, и беременность может успешно продолжаться. В этом процессе также участвуют регуляторные Т-клетки (Treg), которые подавляют сверхактивный воспалительный ответ, ингибируя функцию активированных Т-клеток.
Современные исследования не подтвердили наличие аутоиммунного компонента при ХЭ [5]. Наоборот, выявлено присутствие в эндометрии ЦК, которые секретируют лимфоциты, Т-хелперы и другие иммунные клетки. ЦК – это мессенджеры (пептидные молекулы, передающие информацию), которые способствуют притоку макрофагов и NK-клеток к эндометрию из периферической крови [6]. Гиперэкспрессия провоспалительных ЦК в эндометрии клетками Th1 в ответ на инвазию возбудителей инфекции, наблюдаемая при ХЭ, создает новое состояние, характеризующееся локальным воспалением, основной целью которого является не имплантация, а иммунная защита от экзогенного агента и его эрадикация. Это состояние характеризуется преобладанием Th1 и Th17 над Th2 и Treg, при этом последних оказывается недостаточно для подавления активированных Т-клеток [7–9]. Свой вклад вносит и действие вирусов, способных уклоняться от иммунного ответа, при этом повышается численность NK-клеток, обладающих цитотоксичностью и направленных на уничтожение пораженных вирусами клеток. В то же время наблюдается активация клеток, экспрессирующих CD16+ (рецептор к иммуноглобулину G). Эти клетки выделяют ЦК и цитотоксические факторы к клеткам эндометрия и трофобласта [6], что препятствует имплантации или способствует выкидышу в ранние сроки [10].
Роль иммуномодулирующей терапии в восстановлении фертильности
Воздействия, направленные на улучшение репродуктивных исходов у пациенток с ХЭ, фокусируются на исследовании взаимодействия иммунной системы с микробиотой эндометрия как причины дефекта имплантации [6].
Бесплодие, рецидивирующие неудачи имплантации (РНИ) и привычное невынашивание беременности (ПНБ) у пациенток с ХЭ рассматриваются как результат нарушения иммунных механизмов толерантности матери к полуаллогенному плоду вследствие нарушений в иммунной системе, описанных выше. Поскольку эти изменения являются ответом на инфекцию, то они считаются потенциально модифицируемыми, а применение иммуномодулирующих средств оценивается как перспективное вмешательство для достижения беременности и ее благоприятного исхода, что подтверждено выводами систематического обзора и метаанализа 53 исследований [11]. В данном метаанализе была изучена эффективность таких средств, как аспирин, гепарин, кортикостероиды, гранулоцитарный колониестимулирующий фактор (Г-КСФ), интралипид, рекомбинантный человеческий лейкемия-ингибирующий фактор, иммуноглобулин, мононуклеарные клетки периферической крови (МКПК), ингибиторы фактора некроза опухоли, и для большинства вмешательств доказательства оказались недостаточны. Только два из перечисленных средств – Г-КСФ и МКПК при внутриутробном введении – имели более высокие показатели клинической беременности и живорождения по сравнению с плацебо или отсутствием вмешательства (ОР=1,52; 95% ДИ 1,11–2,10, 5 РКИ, 844 участника и ОР=2,03; 95% ДИ 1,33–3,10, 2 РКИ, 312 участников соответственно), хотя степень доказательств была признана низкой.
Два систематических обзора и метаанализа, включавших 6 и 8 исследований соответственно, выполненных в 2019 г., в которых изучалось внутриматочное лечение аутологичными МКПК у женщин с неудачами ЭКО/ПЭ, показали, что их введение может улучшить показатели наступления беременности и живорождений по сравнению с плацебо: по данным одного – в 2,5 раза (ОШ=2,45 и 2,43 соответственно), в другом – в 2 раза (ОР=1,92 и 1,93 соответственно) [12, 13]. Однако авторы отмечают низкое качество включенных в анализ исследований. И еще один метаанализ 16 РКИ (2022), выполненных среди женщин, которым вводили аутологичные МКПК внутриматочно, представил ограниченные доказательства, что этот метод является лучшим терапевтическим вариантом по сравнению с другими вмешательствами (OР=2,35; 95% ДИ 1,14–4,85) для пациенток с РНИ [14].
В нескольких отечественных исследованиях, где применялось введение МКПК у пациенток с РНИ, также было показано их положительное действие на частоту наступления беременности, превышающую 30% порог [15, 16].
Впервые Yoshioka S. et al. в 2006 г. сообщили, что локальная иммунная терапия с введением МКПК в полость матки может оказывать положительное влияние на имплантацию эмбриона и наступление беременности, обеспечивая регуляцию локального баланса клеток Treg/Th17, что было подтверждено в эксперименте на мышах [17, 18].
МКПК включают клетки, содержащие одно круглое ядро, которые образуются из гемопоэтических стволовых клеток миелоидного и лимфоидного рядов, – моноциты, Т-лимфоциты (хелперные – CD4 и цитотоксические – CD8), В-лимфоциты (CD20), NK-клетки (CD56), дендритные клетки. Активированные CD4+ T-клетки далее делятся на Th1, Th2, Th9, Th17 и Th22, фолликулярные хелперные клетки (Tfh) и Treg [19].
Недостатком описанного метода является необходимость получения аутологичных МКПК непосредственно перед переносом эмбриона, что требует дополнительного времени и является трудоемким. Кроме того, методы подготовки МКПК существенно различаются между исследованиями и не стандартизованы. Данные относительно побочных эффектов, осложнений и неблагоприятных исходов беременности отсутствуют. Обсуждаются онкогенность и возможная передача инфекций. Таким образом, хотя в целом роль аутологичных МКПК, введенных внутриматочно, у пациентов с РНИ оценена как положительная, в настоящее время их клиническое использование экспертами Европейского общества репродукции человека и эмбриологии (European Society of Human Reproduction and Embryology, ESHRE) не рекомендуется [20].
Секретомная терапия – новое направление в восстановлении фертильности у пациенток с ХЭ
Согласно исследованиям, действие МКПК обусловлено большим количеством паракринных факторов (биоактивных молекул), которые секретируют МКПК (секретóм), включающих различные сывороточные белки, факторы роста, ангиогенные факторы, гормоны, ЦК, белки и протеазы, и в небольшом количестве липидные медиаторы и генетический материал. ЦК, такие как ИЛ-1α, ИЛ-1β и фактор некроза опухоли-α, оказывают положительное влияние на эндометрий и его рецептивность [21]. Кроме того, они инициируют и контролируют инвазию трофобласта и развитие плаценты [22], поддерживают баланс между провоспалительным ответом и материнской иммунологической толерантностью [23]. В настоящее время секретóм считается наиболее предпочтительным для регенеративной медицины по сравнению с клеточной терапией. Изучение терапевтического потенциала секретóма позволило исследователям воспроизвести противовоспалительные, проангиогенные и трофические эффекты клеточных технологий без использования самих клеток, и в 2015 г. секретóмная терапия была названа «прорывом в регенеративной медицине» [24].
Еще 1987 г. в России уже был разработан и опубликован метод извлечения секретóма (в то время названный «лимфокины») из МКПК и его стабилизации. Препарат, разрешенный к обращению на территории России, содержащий «лимфокины», получил название Суперлимф. Он представляет собой белково-пептидный комплекс, получаемый из лейкоцитов крови свиней, и содержит супернатант биоактивных молекул, секретируемый Т-, В- и NK-клетками, моноцитами и дендритными клетками. Его применение, по сути, представляет собой новое направление регенеративной медицины. Помимо биологических преимуществ и устранения многих проблем безопасности, связанных с прямым использованием клеток, бесклеточные методы лечения на основе секретóма имеют несколько логистических преимуществ для клинического использования, включая масштабируемость, доступность, более длительные сроки хранения, безопасность [25].
Ключевым компонентом иммунной защиты организмов считают антимикробные пептиды (АМП), обладающие активностью, направленной против бактерий, грибов и вирусов, включая штаммы бактерий, устойчивые к антибиотикам [25]. Наиболее изученным и мощным АМП является протегрин 1, содержащий в своем составе аминокислотные остатки, цепь которых изогнута в виде шпильки, а концы соединены двумя дисульфидными мостиками. Протегрин 1 активирует внутриклеточные механизмы гибели микроорганизмов, а именно – разрушение целостности бактериальной и вирусной оболочки (образование пор), ингибирование синтеза ДНК и активности рибосом и ферментов, участвующих в репарации бактериальной клетки, и выход лизосомальных ферментов (катепсина Д) из лизосом лейкоцитов [26].
ЦК включают хемокины (регулируют миграцию лейкоцитов из крови в ткани), ИЛ (осуществляют взаимодействие между лейкоцитами), интерфероны (белки, блокирующие репликацию вирусов) и факторы некроза опухоли (семейство ЦК, вызывающих апоптоз клеток) [25, 27, 28].
Суперлимф, содержащий АМП и ЦК, оказывает разностороннее действие на клетки врожденного иммунитета – макрофаги, нейтрофилы и естественные киллеры, подавляя экспрессию эндогенных хемокинов противовоспалительными ЦК (ИЛ-4 и ИЛ-10), в результате чего воспалительная реакция в тканях разрешается [29, 30]. Кроме того, компоненты Суперлимфа оказывают выраженное репаративное действие на ткани, поврежденные воспалением, в результате активации тканеспецифичных клеток-предшественников [25].
Вагинальное введение препарата «Суперлимф» максимально приближено к очагу воспаления, что является предпочтительным способом контролируемой неинвазивной доставки препаратов, предназначенных как для местного, так и для системного действия. Однако компоненты Суперлимфа не всасываются в кровоток, а значит, не оказывают системного действия, равно как не происходит местного воздействия его молекул на клетки и ткани. Механизм заключается в модуляции реакций врожденного и адаптивного иммунитета пациента путем воздействия на собственные клетки лимфоидного ряда благодаря эффекту, называемому «хоуминг-эффектом», который обеспечивается сродством лимфоцитов к рецепторам (адрессинам) эндотелия венул, дренирующих слизистые оболочки «домашнего региона» – женского урогенитального тракта. Этот эффект представляет собой миграцию стимулированных антигенами Т-лимфоцитов в лимфоузлы и обратно в очаг инфекции, что и обеспечивает эффективную эрадикацию возбудителей инфекции и противовоспалительное действие [29]. Благодаря «хоуминг-эффекту» введение препарата «Суперлимф» ректально так же эффективно, как и вагинально, поскольку механизм влияния на Т-лимфоциты будет аналогичным.
Эффективность антимикробных пептидов и цитокинов в лечении ХЭ и преодолении бесплодия
В 2018–2024 гг. опубликованы результаты исследований, выполненных отечественными авторами, в которых обсуждаются вопросы взаимосвязи воспалительных и иммунологических изменений при ХЭ, повышения эффективности лечения бесплодия маточного происхождения с использованием комплекса «Суперлимф». Тапильская Н.И. и соавт. (2022) показали, что в 84,0% наблюдений применение Суперлимфа одновременно с АБТ приводит к элиминации инфектов из полости матки против 59,1% при лечении только АБТ с увеличением вероятности восстановления нормальной микробиоты в 5 раз (ОШ=5,4; 95% ДИ 1,5–19,2), а также значимо снижает степень выраженности ХЭ [30]. Дикке Г.Б. и соавт. (2019) продемонстрировали нормализацию локального статуса цитокинов и прекращение выделения вирусов у 66,7% пациенток с ХЭ [31]. Крупномасштабное РКИ с участием 2252 женщин с ХЭ и бесплодием позволило доказать, что применение Суперлимфа на прегравидарном этапе в составе комплексной терапии способствует разрешению ХЭ у 86,0% пациенток [22], наступлению беременности в течение 6 месяцев (суммарно спонтанное и после ЭКО) у 44,9% против 26,1%, получавших только АБТ, с увеличением шанса в 1,5 раза (ОР=1,58; 95% ДИ 1,40–1,78). Показатель живорождения у этих пациенток составил 37,3 и 21,1% соответственно (ОР=1,77; 95% ДИ 1,55–2,03) [30]. Анализ, проведенный через 12 месяцев, показал наступление спонтанной беременности у 83,8% против 45,1% соответственно с увеличением шанса практически в 2 раза (ОР=1,86; 95% ДИ 1,69–2,05), живорождения – 73,5% против 33,6% соответственно (ОР=2,19; 95% ДИ 1,93–2,49). Высокая эффективность отмечена у пациенток с бесплодием 5 лет и более – 89,2% против 16,4% соответственно с увеличением вероятности наступления спонтанной беременности в 5,4 раза по сравнению с теми, кто получал только АБТ (ОР=5,43; 95% ДИ 3,69–8,01), живорождения – 76,5% против 11,9% соответственно (ОР=6,40; 95% ДИ 3,99–10,27) [6].
Указанная комплексная терапия и добавление к ней прогестерона привели к повышению частоты наступления спонтанной беременности в среднем на 20%, а также снижению осложнений: самопроизвольных выкидышей в ранние сроки – в 6 раз, преждевременных родов – в 2,5 раза, преэклампсии, гипоксии и задержки роста плода – в 2 раза по сравнению с лечением только АБТ [6]. При этом статистически значимой разницы между группами, получавшими гестаген/АБТ (без Суперлимфа) и только АБТ, не было. Изучению роли препарата «Суперлимф» в восстановлении фертильности посвящена серия работ Доброхотовой Ю.Э. и соавт., показавших, что у пролеченных пациенток происходит восстановление экспрессии факторов врожденного иммунитета, рецепторов к прогестерону в эпителии и строме эндометрия (в 3 и 2,7 раза соответственно), улучшение показателей ангиогенеза и васкуляризации ткани эндометрия, что приводит к купированию хронического воспаления и нормализации рецептивности ткани [32–34].
В программах вспомогательных репродуктивных технологий (ВРТ) с криопереносом комплексная терапия с использованием Суперлимфа на прегравидарном этапе способствовала наступлению беременности у 57,0% пациенток против 38,7% (ОР=1,47; 95% ДИ 1,24–1,75), живорождению – у 45,3% против 20,7% соответственно (ОР=2,19; 95% ДИ 1,70–2,83), а также снижению риска выкидыша в ранние сроки, преждевременных родов и рождения маловесных детей, преэклампсии – в 2 раза по сравнению с терапией без него, гипоксии и задержки роста плода – в 3 раза, антенатальной гибели плода – в 6,7 раза [35]. Дополнительный анализ показал, что успех ЭКО увеличивается после лечения ХЭ: при условии его разрешения клиническая беременность диагностирована у 70,3% против 6,2% при персистирующем ХЭ, живорождений – у 52,1% против 2,4% соответственно, р<0,0001.
Рекомендации ESHRE по надлежащей практике в отношении РНИ предлагают индивидуальный подход к каждой пациентке/супружеской паре, у которой перенос эмбрионов не приводит к наступлению беременности. После более двух неудачных попыток ЭКО рекомендуется ставить вопрос о дополнительном обследовании и лечении, если индивидуальный прогноз успешного вмешательства низкий. Предлагается рекомендуемый порог для совокупного прогнозируемого шанса имплантации 60%. Эксперты отмечают, что в идеале следует использовать модель прогнозирования, включающую множество факторов, для оценки совокупного шанса успешной имплантации, но в настоящее время такая модель недоступна. В связи с чем рекомендуется использовать опубликованные данные наблюдательных исследований или собственные данные центров ВРТ [20].
Прогнозирование успеха ВРТ у пациенток с бесплодием маточного происхождения
В рамках проведенного анализа литературы оценены несколько моделей прогноза вероятности беременности/живорождения после 1–3 циклов ЭКО, в которые включены множество клинических и лабораторных переменных (в одном из исследований – около 100), количество извлеченных ооцитов; во всех этих моделях точность прогноза была ограничена – менее 60% (AUC (Area Under Curve – площадь под ROC-кривой) от 0,51 до 0,60) [36–40]. В модели Choi B. et al. (2013), включающей антимюллеров гормон, достигнута точность прогноза 71% [41]. В последующем McLernon D.J. et al. (2016) разработана более информативная модель, предназначенная для прогноза в 6 циклах ЭКО, с показателем прогностической ценности до ЭКО – 73%, после первого цикла – 72% (за исключением необъяснимого бесплодия) [42]. Модель Xu T. et al. (2022) ограничивается прогнозированием беременности сразу после цикла ЭКО, но не живорождения, с точностью 68% [43].
В систематическом обзоре 2020 г. авторами дана оценка качества 35 моделей прогнозирования ЭКО, наиболее качественной и информативной признана модель Маклернона [44]. Отметим, что объем данных, использованных в разработанных ранее моделях, ограничен возможностями статистического анализа с помощью компьютерных программ, и весь массив полученных биологических параметров остается невостребованным, что не позволяет определить их ценность для прогноза. Преодолеть этот недостаток оказалось возможным благодаря внедрению в медицинскую практику моделей, основанных на современных алгоритмах, таких как нейронные сети [45]. Глубокое машинное обучение (анализ медицинских изображений) также рассматривают как перспективное направление для целей репродуктологии [46, 47].
Хотя искусственный интеллект (ИИ) демонстрирует многообещающие результаты, он пока не признан «золотым стандартом» и не внедрен в клиническую практику. Это явилось основанием для систематического обзора 18 исследований, в котором проведена оценка прогностических возможностей моделей на основе ИИ [48]. Результаты анализа показали, что такие модели могут точно предсказывать результат ЭКО для клинической беременности (72%) и живорождения (90%). Однако применение этих технологий в рутинной практике ограничено ввиду использования дорогостоящего программного обеспечения и трудоемкости, а моделей прогноза для наступления спонтанной беременности после лечения ХЭ не разработано.
Таким образом, практический интерес относительно прогноза беременности/живорождения у пациенток с бесплодием, обусловленным ХЭ, остается неудовлетворенным.
С помощью нейросетевой технологии нами были разработаны 2 модели прогноза для пациенток с бесплодием маточного происхождения, обусловленным ХЭ: модель 1 для прогноза спонтанной беременности (точность прогноза – 88,0%, чувствительность – 94,2%, специфичность – 82,4%) [49] и модель 2 для прогноза успешности ЭКО с оценкой вероятности наступления беременности, спонтанного выкидыша и живорождения (точность прогноза – 97,9%, чувствительность – 100%, специфичность – 96,4%) [50]. Для практического применения моделей индивидуального прогноза на их основе разработаны онлайн-калькуляторы. Результат позволяет определить необходимость проведения повторного(-ых) курса лечения ХЭ (при отрицательном или сомнительном прогнозе) либо принять решение о планировании беременности или проведении ЭКО (при положительном).
Информативность нейросетевого анализа данных в прогнозировании спонтанной беременности или исхода ЭКО у пациенток с бесплодием, обусловленным ХЭ, подтверждена ROC-анализом и включает 8 и 12 параметров для моделей 1 и 2 соответственно, имеющих важное значение для прогноза и патогенетически обоснованных. Один из параметров – применение Суперлимфа (да/нет) имеет существенный вес для прогноза и включен в обе модели. В связи с этим нас интересовал вопрос: сколько курсов лечения комплексом «Суперлимф» необходимо провести для получения наиболее эффективного результата.
Таким образом, цель настоящего исследования: сравнить эффективность комплексного лечения в прегравидарном периоде пациенток с бесплодием, обусловленным ХЭ, в достижении спонтанной беременности и живорождения с использованием препарата «Суперлимф» одним и двумя курсами.
Материалы и методы
Дизайн. Проспективное сравнительное продольное интервенционное клиническое исследование в параллельных группах.
Организация исследования. Набор материала и наблюдение проводились с сентября 2020 г. по май 2024 г. на базе ГБУЗ ТО «Перинатальный центр» (Тюмень, Россия). При подготовке протокола исследования учитывались положения Хельсинкской декларации Всемирной медицинской ассоциации (пересмотр 2013 г.), других законодательных и нормативных международных и отечественных документов. Исследование получило положительное заключение локального Комитета по этике. Все пациентки подписали информированное добровольное согласие на участие в исследовании.
Материалы. В исследование включены 606 пациенток с диагнозом «бесплодие маточного происхождения и хронический эндометрит». Расчет объема выборки выполняли с помощью программы G*Power (Heinrich-Heine-Universität Düsseldorf, Германия). В расчет были приняты сведения о частоте наступления спонтанной беременности у пациенток после лечения ХЭ Суперлимфом (один курс), которая составила 23,3%. Предполагаемое увеличение эффективности с использованием двух курсов Суперлимфа – на 20%. Учитывали α (значение допустимой ошибки первого рода) 0,05; β (значение допустимой ошибки второго рода) 0,2, коэффициент распределения 1/1. Количество пациенток для обеспечения не менее 80% мощности статистического теста для проведения данного исследования должно составлять не менее 540 на условиях intent-to-treat (получающие лечение) – по 270 пациенток в каждой группе. С учетом возможного выбывания пациенток или неполных данных дополнительно включено 10% полученного значения выборки – 594. Первоначально оценены на приемлемость участия в исследовании 610 пациенток с ХЭ. Отобраны и включены в окончательный анализ 606 участников (по 303 в каждую группу).
Критерии включения: возраст 18–45 лет; диагноз: N97.2 Женское бесплодие маточного происхождения, дефект имплантации яйцеклетки и N71.1 Хроническая воспалительная болезнь матки (подтверждено гистологическим и иммуногистохимическим методами); отсутствие непроходимости маточных труб и гипоплазии эндометрия; овуляторный менструальный цикл; изокоагуляция крови; отсутствие противопоказаний к применяемым лекарственным средствам.
Критерии исключения: мужской фактор бесплодия; гинекологические заболевания (миома матки, эндометриоз, кисты яичников, интраэпителиальные поражения шейки матки, в том числе в анамнезе); пороки развития; иные причины бесплодия; инфекции, передаваемые половым путем и/или инфекционно-воспалительные заболевания нижнего отдела полового тракта в течение последних 6 месяцев; тяжелые соматические заболевания; резус-отрицательная кровь; повышенная индивидуальная чувствительность к применяемым лекарственным средствам.
Вмешательства. В I группе пациентки в составе комплексной терапии применяли препарат «Суперлимф» (МНН: белково-пептидный комплекс из лейкоцитов крови свиней, ООО «Альтфарм», Россия) суппозитории по 25 ЕД 1 раз в день вагинально вечером в течение 20 дней, во II группе – в составе комплексной терапии получали Суперлимф по той же схеме, но двумя курсами с перерывом между ними 1–1,5 месяца. В обеих группах пациентки получали один курс АБТ и гестаген (дидрогестерон 10 мг с 15-го по 26-й дни цикла до наступления спонтанной беременности, но не более 6 месяцев). Беременность планировалась после завершения лечения и процедур контрольного обследования в следующем цикле.
Методы обследования. Применялось комплексное обследование пациенток с использованием клинических, принятых в гинекологии, и лабораторных методов. Оценку проводили до включения пациенток в исследование и начала лечения.
Оценка результатов. Первичные результаты – частота наступления клинической беременности в течение 6 месяцев после лечения (визуализация плодного яйца по данным УЗИ в сроке 6–8 недель) и частота живорождения (в срок 240–406 недель). Вторичные результаты – частота и гестационный срок выкидышей (до 236 недель), преждевременных (240–366 недель) и срочных (370–416 недель) родов.
Анализ проводился на основании данных, внесенных в электронную базу после того, как все результаты были проверены как готовые к анализу. Сведения о пациентках с неполными данными были удалены.
Статистический анализ
Статистический анализ осуществляли при помощи пакета программ Statistica for Windows 10.0 (StatSoft Inc., США). Критерий Колмогорова–Смирнова использовали для оценки распределения признаков. Нормально распределенные непрерывные переменные определялись как средние значения (М) со стандартными отклонениями (SD), в остальных случаях – в виде медианы (Ме) с межквартильными диапазонами (Q1; Q3). Качественные признаки указывали абсолютными числами (n) и относительными величинами (%). Различия в независимых выборках определяли с помощью U-критерия Манна–Уитни, качественные признаки анализировали при помощи критерия χ2. Принят уровень значимости р<0,05 при уровнях ошибки первого и второго рода α=5% и β=20% соответственно. Анализ проводили в зависимости от назначенного вмешательства (intention-to-treat analysis). Взаимосвязь лечебного фактора и исхода оценивали по величине относительного риска (ОР) с вычислением 95% доверительного интервала (ДИ).
Результаты
Общие сведения о пациентках. Возраст пациенток варьировал от 18 до 45 лет и в I группе составил 36,0 (3,1) года, во II группе – 35,9 (4,4) года, р=0,22. Социальная и клиническая характеристики пациенток представлены в таблице 1.
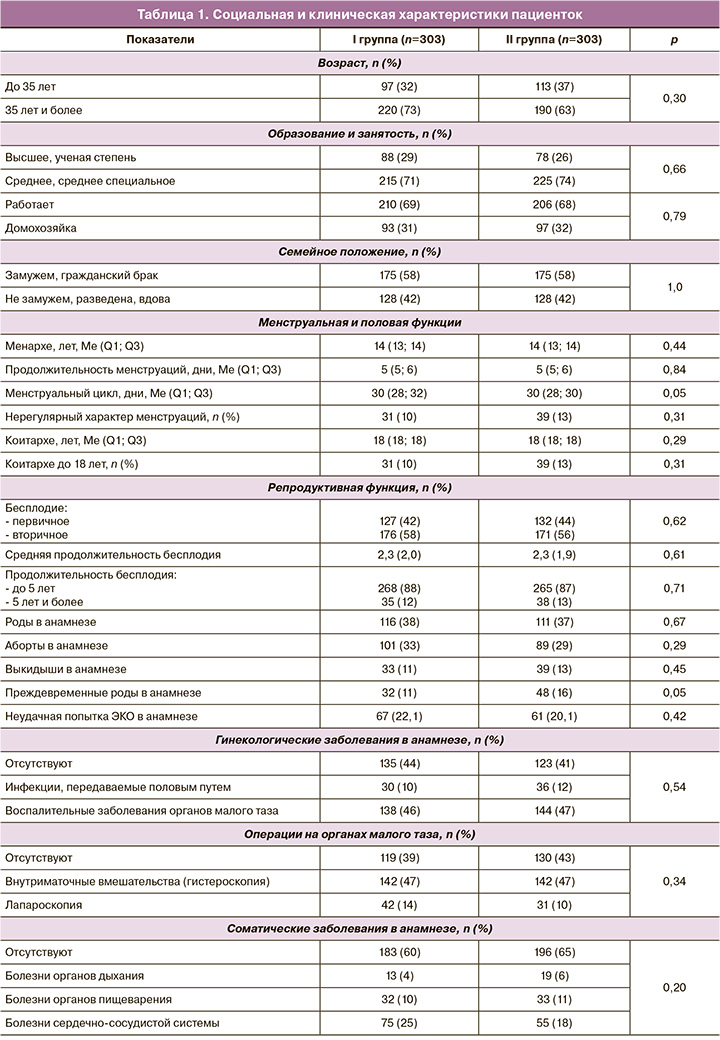
Анализ данных таблицы 1 показал отсутствие статистически значимых различий между I и II группами по социальным и клиническим характеристикам пациенток. Индивидуальные показатели физикального осмотра по органам и системам у пациенток обеих групп были сопоставимы.
Оценка эффективности лечения
Первичные исходы представлены в таблице 2. Частота наступления беременности в течение 6 месяцев после лечения составила 52,2% против 63,4% в I и II группах соответственно, р=0,05. Во II группе вероятность наступления спонтанной беременности была выше на 22% по сравнению с I группой (ОР=1,22; 95% ДИ 1,06–1,40). При этом максимальная разница была при наступлении беременности в первый месяц после окончания лечения – 15,5% против 31,4% соответственно, р<0,001, и выше в 2 раза во II группе по сравнению с I (ОР=2,02; 95% ДИ 1,48–2,75). Частота наступления беременности в более поздние сроки (на 2–6-м месяце) была сопоставимой, но при этом в течение 2-го месяца все еще оставалась достаточно высокой в обеих группах.
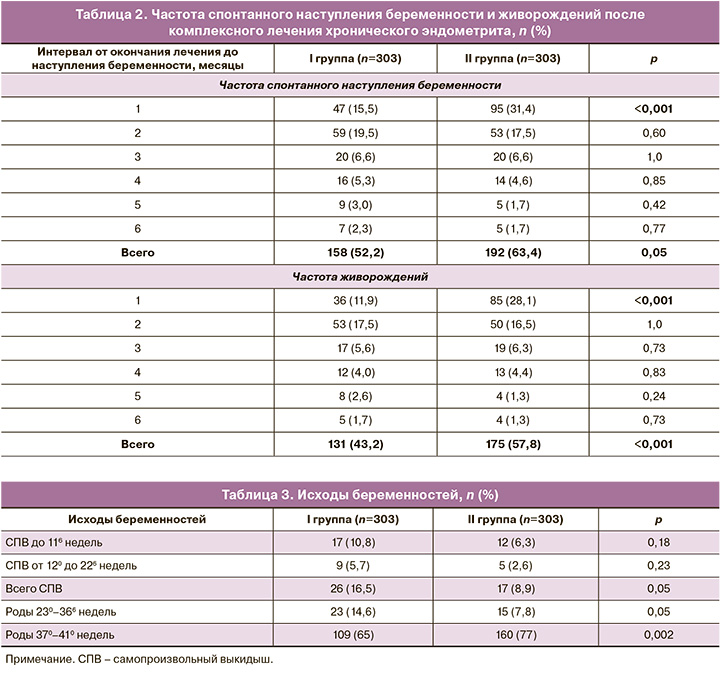
Частота живорождений составила 43,2% против 57,8% в I и II группах соответственно, р=0,05. Во II группе вероятность живорождений была выше на 34% по сравнению с I (ОР=1,34; 95% ДИ 1,14–1,57). При этом максимальная разница в частоте живорождений была при наступлении беременности в первый месяц после окончания лечения 11,9% против 28,1% в I и II группах соответственно, р<0,001, и выше в 2,4 раза во II группе по сравнению с I (ОР=2,36; 95% ДИ 1,65–3,37). Частота живорождений при наступлении беременности в более поздние сроки (на 2–6-м месяце) была сопоставимой, но достаточно высокой на 2-м месяце в обеих группах. Средний интервал между окончанием приема Суперлимфа и наступлением беременности составил в I группе 2,4 (1,4) месяца, во II – 1,9 (1,2) месяца, р<0,001.
Вторичные исходы представлены в таблице 3. Общая частота выкидышей в ранние и поздние сроки беременности у пациенток, получавших комплексное лечение по поводу ХЭ, составила 16,5% против 8,9% в I и II группах соответственно, р=0,05; при этом риск выкидышей был в 2 раза ниже во II группе (ОР=0,54; 95% ДИ 0,39–0,96). Прерывание беременности чаще наблюдалось в I триместре в обеих группах, но частота не превышала 10%.
Общая частота преждевременных родов (до 366 недель) составила 14,6% против 7,8% в группах соответственно, р=0,05, с уменьшением риска рождения недоношенного ребенка почти в 2 раза во II группе (ОР=0,54; 95% ДИ 0,29–0,99). Вероятность срочных родов была выше во II группе по сравнению с I (ОР=1,21; 95% ДИ 1,07–1,37, р=0,002).
Таким образом, прием Суперлимфа двумя курсами способствовал увеличению вероятности наступления спонтанной беременности, живорождений и срочных родов, снижению риска самопроизвольного выкидыша и преждевременных родов.
Обсуждение
Лечение женщин с бесплодием, обусловленным ХЭ, все еще остается нерешенной проблемой, что обусловлено сложностью патогенеза и до сих пор не установленными рекомендациями по лечению [6].
Исследование, выполненное Доброхотовой Ю.Э. и соавт. [34], показало, что использование препарата «Суперлимф» 25 ЕД (продолжительностью 20 и 40 дней) в лечении пациенток с ХЭ на прегравидарном этапе способствует увеличению частоты наступления беременности (44,2 и 57,5% соответственно, как спонтанной, так и после ЭКО), но частота беременности, наступившей спонтанно, в этом исследовании составила 23,3% (10/43) и 37,5% (15/40), р=0,24, соответственно, а полученные в настоящем исследовании результаты оказались выше – 52,2% против 63,4% соответственно (р=0,05). Такое расхождение можно объяснить различием применявшихся курсов лечения: в сравниваемом исследовании пациентки получали сначала АБ, а уже после него курс лечения препаратом «Суперлимф», причем 40-дневный курс проводился без перерыва, а гестагенная поддержка не применялась. В исследовании Тапильской Н.И. и соавт. [30] АБ и первый курс Суперлимфа применялись одновременно, второй проводился через 3 недели, что способствовало элиминации микроорганизмов у 84,0% пациенток и сопровождалось разрешением ХЭ (показатели наступления беременности не приводятся). Оценка роли гестагенной поддержки в комплексе лечения, проведенная нами дополнительно по базе данных [6], показала, что она оказывает положительное влияние, способствуя увеличению частоты наступления беременности в среднем на 20%.
Оптимизация лечения путем применения комплексной терапии, включающей АБ, гестаген и два курса Суперлимфа по 20 дней с перерывом 1–1,5 месяца, показала лучшие результаты по сравнению с терапией одним курсом с увеличением вероятности наступления беременности еще на 22%, живорождений на 34% и снижением риска выкидышей и преждевременных родов в 2 раза.
Важным результатом настоящего исследования является то, что продемонстрированы более высокая частота наступления беременности в первый месяц после окончания лечения, имевшая статистически значимую разницу как при применении двух курсов лечения, так и одного, и достаточно хорошие показатели на втором месяце. Это позволяет рекомендовать интервал ожидания наступления беременности до 2 месяцев после одного курса приема Суперлимфа и при отсутствии беременности назначить второй. Если после двух курсов терапии беременность на наступила в течение ближайших 2–3 месяцев, следует оценить прогноз и при отрицательном результате принять решение о проведении ЭКО, предварительно определив прогноз успешности ЭКО с помощью предлагаемых калькуляторов [49, 50].
Заключение
Лечение ХЭ с использованием препарата «Суперлимф» в дозе 25 ЕД двумя курсами (по 20 введений на курс с перерывом 1–1,5 месяца) одновременно с АБТ (10 дней) и прогестероном во вторую фазу цикла (2–6 месяцев) в прегравидарном периоде обладает высокой клинической эффективностью и увеличивает шансы наступления спонтанной беременности на 22%, живорождений – на 34% и способствует снижению риска выкидышей и преждевременных родов в 2 раза по сравнению с применением одним курсом.
Список литературы
- Salamonsen L.A., Evans J., Nguyen H.P., Edgell T.A. The microenvironment of human implantation: determinant of reproductive success. Am. J. Reprod. Immunol. 2016; 75(3): 218-25. https://dx.doi.org/10.1111/aji.12450.
- Fox C., Morin S., Jeong J.W., Scott R.T. Jr, Lessey B.A. Local and systemic factors and implantation: what is the evidence? Fertil. Steril. 2016; 105(4): 873-84. https://dx.doi.org/10.1016/j.fertnstert.2016.02.018.
- Zenclussen A.C., Hämmerling G.J. Cellular regulation of the uterine microenvironment that enables embryo implantation. Front. Immunol. 2015; 6: 321. https://dx.doi.org/10.3389/fimmu.2015.00321.
- PrabhuDas M., Bonney E., Caron K., Dey S., Erlebacher A., Fazleabas A. et al. Immune mechanisms at the maternal-fetal interface: perspectives and challenges. Nat. Immunol. 2015; 16(4): 328-34. https://dx.doi.org/10.1038/ni.3131.
- Kushnir V.A., Solouki S., Sarig-Meth T., Vega M.G., Albertini D.F., Darmon S.K. et al. Systemic inflammation and autoimmunity in women with chronic endometritis. Am. J. Reprod. Immunol. 2016; 75(6): 672-7. https://dx.doi.org/10.1111/aji.12508.
- Дикке Г.Б., Суханов А.А., Остроменский В.В., Кукарская И.И. Течение и исходы беременности у пациенток с хроническим эндометритом и нарушением репродуктивной функции, получавших комплексное лечение с использованием препарата «Суперлимф» (рандомизированное контролируемое испытание в параллельных группах «ТЮЛЬПАН»). Акушерство и гинекология. 2023; 4: 132-44.
- Wang W., Sung N., Gilman-Sachs A., Kwak-Kim J. T Helper (Th) cell profiles in pregnancy and recurrent pregnancy losses: Th1/Th2/Th9/Th17/Th22/Tfh cells. Front. Immunol. 2020; 11: 2025. https://dx.doi.org/10.3389/fimmu.2020.02025.
- Kofod L., Lindhard A., Hviid T.V.F. Implications of uterine NK cells and regulatory T cells in the endometrium of infertile women. Hum. Immunol. 2018; 79(9): 693-701. https://dx.doi.org/10.1016/j.humimm.2018.07.003.
- Park H.J., Kim Y.S., Yoon T.K., Lee W.S. Chronic endometritis and infertility. Clin. Exp. Reprod. Med. 2016; 43(4): 185-92. https://dx.doi.org/10.5653/cerm.2016.43.4.185.
- Li X., Zhou J., Fang M., Yu B. Pregnancy immune tolerance at the maternal-fetal interface. Int. Rev. Immunol. 2020; 39(6): 247-63. https://dx.doi.org/10.1080/08830185.2020.1777292.
- Melo P., Thornton T., Coomarasamy A., Granne I. Evidence for the effectiveness of immunologic therapies in women with subfertility and/or undergoing assisted reproduction. Fertil. Steril. 2022; 117(6): 1144-59. https://dx.doi.org/10.1016/j.fertnstert.2022.04.015.
- Wu Y., Li L., Liu L., Yang X., Yan P., Yang K. et al. Autologous peripheral blood mononuclear cells intrauterine instillation to improve pregnancy outcomes after recurrent implantation failure: a systematic review and meta-analysis. Arch. Gynecol. Obstet. 2019; 300(5): 1445-9. https://dx.doi.org/10.1007/s00404-019-05275-w.
- Maleki-Hajiagha A., Razavi M., Rezaeinejad M., Rouholamin S., Almasi-Hashiani A., Pirjani R. et al. Intrauterine administration of autologous peripheral blood mononuclear cells in patients with recurrent implantation failure: A systematic review and meta-analysis. J. Reprod. Immunol. 2019; 131: 50-6. https://dx.doi.org/10.1016/j.jri.2019.01.001.
- Liu M., Yuan Y., Qiao Y., Tang Y., Sui X., Yin P. et al. The effectiveness of immunomodulatory therapies for patients with repeated implantation failure: a systematic review and network meta-analysis. Sci. Rep. 2022; 12(1):18434. https://dx.doi.org/10.1038/s41598-022-21014-9.
- Амян Т.С., Перминова С.Г., Кречетова Л.В., Вторушина В.В. Эффективность внутриматочного введения аутологичных мононуклеарных клеток периферической крови перед переносом эмбрионов у пациенток с повторными неудачами имплантации в программах вспомогательных репродуктивных технологий. Гинекология. 2018; 20(2): 28-33.
- Вторушина В.В., Перминова С.Г., Кречетова Л.В. Исходы программ ВРТ на фоне внутриматочного введения аутологичных мононуклеарных клеток у женщин с повторными неудачами имплантации. Российский иммунологический журнал. 2021; 24(3): 425-34.
- Yoshioka S., Fujiwara H., Nakayama T., Kosaka K., Mori T., Fujii S. Intrauterine administration of autologous peripheral blood mononuclear cells promotes implantation rates in patients with repeated failure of IVF-embryo transfer. Hum. Reprod. 2006; 21(12): 3290-4. https://dx.doi.org/10.1093/humrep/del312.
- Fan L., Sha M., Li W., Kang Q., Wu J., Chen S. et al. Intrauterine administration of peripheral blood mononuclear cells (PBMCs) improves embryo implantation in mice by regulating local Treg/Th17 cell balance. J. Reprod. Dev. 2021; 67(6): 359-68. https://dx.doi.org/10.1262/jrd.2021-006.
- Sen P., Kemppainen E., Orešič M. Perspectives on systems modeling of human peripheral blood mononuclear cells. Front. Mol. Biosci. 2018; 4: 96. https://dx.doi.org/10.3389/fmolb.2017.00096.
- Cimadomo D., de Los Santos M.J., Griesinger G., Lainas G., Le Clef N., McLernon D.J. et al.; ESHRE Working Group on Recurrent Implantation Failure. ESHRE good practice recommendations on recurrent implantation failure. Hum. Reprod. Open. 2023; 2023(3): hoad023. https://dx.doi.org/10.1093/hropen/hoad023.
- Yu N., Yan W., Yin T., Wang Y., Guo Y., Zhou D. et al. HCG-activated human peripheral blood mononuclear cells (PBMC) promote trophoblast cell invasion. PLoS One. 2015; 10(6): e0125589. https://dx.doi.org/10.1371/journal.pone.0125589.
- Дикке Г.Б., Суханов А.А., Кукарская И.И., Остроменский В.В. Восстановление репродуктивной функции у пациенток с маточной формой бесплодия, обусловленной хроническим эндометритом. Фарматека. 2022; 29(6): 86-94.
- Yakin K., Oktem O., Urman B. Intrauterine administration of peripheral mononuclear cells in recurrent implantation failure: a systematic review and meta-analysis. Sci. Rep. 2019; 9(1): 3897. https://dx.doi.org/10.1038/s41598-019-40521-w.
- Daneshmandi L., Shah S., Jafari T., Bhattacharjee M., Momah D., Saveh-Shemshaki N. et al. Emergence of the stem cell secretome in regenerative engineering. Trends Biotechnol. 2020; 38(12): 1373-84. https://dx.doi.org/10.1016/j.tibtech.2020.04.013.
- Юшкова Т.А., Слабинская Е.В., Яковлев А.А. Клиническая фармакология Суперлимфа при заболеваниях урогенитального тракта через призму уровней реализации его эффектов. Эффективная фармакотерапия. 2023; 19(37): 44-53.
- Абатуров А.Е. Катионные антимикробные пептиды системы неспецифической защиты респираторного тракта: дефензины и кателицидины. Дефензины - молекулы, переживающие ренессанс. Часть 1. Здоровье ребенка. 2011; 7(34).
- Eming S.A., Krieg T., Davidson J.M. Inflammation in wound repair: molecular and cellular mechanisms. J. Invest. Dermatol. 2007; 127(3): 514-25. (in Russian)]. https://dx.doi.org/10.1038/sj.jid.5700701.
- Кореева Н.В., Доброхотова Ю.Э. Локальная цитокинотерапия в гинекологической практике (обзор литературы). Проблемы репродукции. 2013; (4): 21-6.
- Huang Y., Wu Q., Tam P.K.H. Immunomodulatory mechanisms of mesenchymal stem cells and their potential clinical applications. Int. J. Mol. Sci. 2022; 23(17): 10023. https://dx.doi.org/10.3390/ijms23171002.
- Тапильская Н.И., Толибова Г.Х., Савичева А.М., Копылова А.А., Глушаков Р.И., Будиловская О.В., Крысанова А.А., Горский А.Г., Гзгзян А.М., Коган И.Ю. Эффективность локальной цитокинотерапии хронического эндометрита пациенток с бесплодием. Акушерство и гинекология. 2022; 2: 91-100.
- Дикке Г.Б., Остроменский В.В. Нарушение иммунного статуса при хроническом эндометрите и опыт его коррекции посредством локальной цитокинотерапии. Акушерство и гинекология. 2019; 9: 139-46.
- Доброхотова Ю.Э., Ганковская Л.В., Боровкова Е.И., Нугуманова О.Р. Экзогенная цитокинотерапия в лечении пациенток с хроническим эндометритом. Акушерство и гинекология. 2021; 2: 119-26.
- Доброхотова Ю.Э., Боровкова Е.И., Скальная В.С., Ильязов Т.К., Рассохина О.В. Клинико-иммунологические параллели у пациенток с бесплодием и хроническим эндометритом до и после экзогенной цитокинотерапии. Акушерство и гинекология. 2019; 12: 154-60.
- Доброхотова Ю.Э., Боровкова Е.И., Нугуманова О.Р. Улучшение процессов ангиогенеза и репродуктивных исходов у пациенток с хроническим эндометритом. Акушерство и гинекология. 2021; 3: 145-52.
- Суханов А.А., Дикке Г.Б., Остроменский В.В., Кукарская И.И., Шилова Н.В. Течение и исходы беременности, наступившей в результате экстракорпорального оплодотворения, у пациенток с хроническим эндометритом, получавших комплексное лечение с использованием препарата «Суперлимф» на прегравидарном этапе (рандомизированное контролируемое испытание «ТЮЛЬПАН 2»). Акушерство и гинекология. 2023; 8: 123-34.
- Lukaszuk K., Kunicki M., Liss J., Lukaszuk M., Jakiel G. Use of ovarian reserve parameters for predicting live births in women undergoing in vitro fertilization. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013; 168(2): 173-7. https://dx.doi.org/10.1016/j.ejogrb.2013.01.013.
- Bjercke S., Fedorcsak P., Åbyholm T., Storeng R., Ertzeid G., Oldereid N. et al. IVF/ICSI outcome and serum LH concentration on day 1 of ovarian stimulation with recombinant FSH under pituitary suppression. Hum. Reprod. 2005;20(9): 2441-7. https://dx.doi.org/10.1093/humrep/dei101.
- Vaegter K.K., Lakic T.G., Olovsson M., Berglund L., Brodin T., Holte J. Which factors are most predictive for live birth after in vitro fertilization and intracytoplasmic sperm injection (IVF/ICSI) treatments? Analysis of 100 prospectively recorded variables in 8,400 IVF/ICSI single-embryo transfers. Fertil. Steril. 2017; 107(3): 641-8.e2. https://dx.doi.org/10.1016/j.fertnstert.2016.12.005.
- Nelson S.M., Lawlor D.A. Predicting live birth, preterm delivery, and low birth weight in infants born from in vitro fertilisation: a prospective study of 144,018 treatment cycles. PLoS Med. 2011; 8(1): e1000386. https://dx.doi.org/10.1371/journal.pmed.1000386.
- Dhillon R.K., McLernon D.J., Smith P.P., Fishel S., Dowell K., Deeks J.J. et al. Predicting the chance of live birth for women undergoing IVF: a novel pretreatment counselling tool. Hum. Reprod. 2016; 31(1): 84-92. https://dx.doi.org/10.1093/humrep/dev268.
- Choi B., Bosch E., Lannon B.M., Leveille M.C., Wong W.H., Leader A. et al. Personalized prediction of first-cycle in vitro fertilization success. Fertil. Steril. 2013; 99(7): 1905-11. h https://dx.doi.org/10.1016/j.fertnstert.2013.02.016.
- McLernon D.J., Steyerberg E.W., Te Velde E.R., Lee A.J., Bhattacharya S. Predicting the chances of a live birth after one or more complete cycles of in vitro fertilisation: population based study of linked cycle data from 113 873 women. BMJ. 2016; 355: i5735. https://dx.doi.org/10.1136/bmj.i5735.
- Xu T., de Figueiredo Veiga A., Hammer K.C., Paschalidis I.C., Mahalingaiah S. Informative predictors of pregnancy after first IVF cycle using eIVF practice highway electronic health records. Sci. Rep. 2022; 12(1): 839. https://dx.doi.org/10.1038/s41598-022-04814-x.
- Ratna M.B., Bhattacharya S., Abdulrahim B., McLernon D.J. A systematic review of the quality of clinical prediction models in in vitro fertilisation. Hum. Reprod. 2020; 35(1): 100-16. https://dx.doi.org/10.1093/humrep/dez258.
- Tomita S. Unlocking the potential of bioanalytical data through machine learning. Anal. Sci. 2023; 39(12): 1937-8. https://dx.doi.org/10.1007/s44211-023-00447-w.
- VerMilyea M., Hall J.M.M., Diakiw S.M., Johnston A., Nguyen T., Perugini D. et al. Development of an artificial intelligence-based assessment model for prediction of embryo viability using static images captured by optical light microscopy during IVF. Hum. Reprod. 2020; 35(4): 770-84. https://dx.doi.org/10.1093/humrep/deaa013.
- Mihara M., Yasuo T., Kitaya K. Precision medicine for chronic endometritis: computer-aided diagnosis using deep learning model. Diagnostics (Basel). 2023; 13(5): 936. https://dx.doi.org/10.3390/diagnostics13050936.
- Sfakianoudis K., Maziotis E., Grigoriadis S., Pantou A., Kokkini G., Trypidi A. et al. Reporting on the value of artificial intelligence in predicting the optimal embryo for transfer: a systematic review including data synthesis. Biomedicines. 2022; 10(3): 697. https://dx.doi.org/10.3390/biomedicines10030697.
- Суханов А.А., Дикке Г.Б., Мудров В.А., Кукарская И.И. Прогнозирование наступления спонтанной беременности у пациенток с хроническим эндометритом и нарушением репродуктивной функции с помощью нейросетевой технологии (вторичный анализ результатов рандомизированного контролируемого испытания «ТЮЛЬПАН»). Акушерство и гинекология. 2024; 2: 106-16.
- Суханов А.А., Дикке Г.Б., Мудров В.А., Кукарская И.И. Прогнозирование успеха экстракорпорального оплодотворения у пациенток с хроническим эндометритом и нарушением репродуктивной функции с помощью нейросетевой технологии (вторичный анализ результатов рандомизированного контролируемого испытания «ТЮЛЬПАН 2»). Акушерство и гинекология. 2024; 4: 103-14.
Поступила 13.08.2024
Принята в печать 20.08.2024
Об авторах / Для корреспонденции
Суханов Антон Александрович, к.м.н., заведующий отделением планирования семьи и репродукции, Перинатальный центр, 625002, Россия, Тюмень, ул. Даудельная,д. 1; доцент кафедры акушерства и гинекологии, Тюменский государственный медицинский университет Минздрава России, 625013, Россия, Тюмень, ул. Пермякова,
д. 10, such-anton@yandex.ru, https://orcid.org/0000-0001-9092-9136
Дикке Галина Борисовна, д.м.н., профессор кафедры акушерства и гинекологии с курсом репродуктивной медицины, Академия медицинского образования
им. Ф.И. Иноземцева, 190013, Россия, Санкт-Петербург, Московский пр-т, д. 22, литер М, galadikke@yandex.ru, https://orcid.org/0000-0001-9524-8962
Кукарская Ирина Ивановна, д.м.н., профессор кафедры акушерства, гинекологии и реаниматологии с курсом клинической лабораторной диагностики Института непрерывного профессионального развития, Тюменский государственный медицинский университет Минздрава России, 625013, Россия, Тюмень, ул. Пермякова, д. 10; главный врач, Перинатальный центр, 625002, Россия, Тюмень, ул. Даудельная, д. 1; главный специалист по акушерству и гинекологии Департамента здравоохранения Тюменской области, kukarskay@mail.ru, https://orcid.org/0000-0002-8275-3553
Автор, ответственный за переписку: Антон Александрович Суханов, such-anton@yandex.ru












