Терапия №10 / 2025
Новый взгляд на нутритивную поддержку при хронической болезни почек: модель питания PLADO
1) ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России, г. Москва;
2) ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский университет)
Аннотация. Хроническая болезнь почек (ХБП) сопровождается снижением функции этого органа и увеличением риска сердечно-сосудистой смертности. Правильно подобранный рацион питания может сыграть большую роль в замедлении прогрессирования данного заболевания. Низкобелковая модель питания с преобладанием растительных источников (PLADO – Plant-DOminant low-protein diet) – многообещающая диетическая стратегия при ХБП. Сочетание сниженной белковой нагрузки и повышенного потребления пищевых волокон способствует сохранению функции почек, уменьшению активности системного воспаления, оптимизации метаболического статуса и снижению сердечно-сосудистого риска. Несмотря на доказанные преимущества PLADO-рациона, существует ряд ограничений для его применения, поэтому для оказания комплексной помощи и достижения эффективных результатов лечения пациентам с ХБП необходима поддержка врача-диетолога. В настоящем обзоре обобщены текущие данные, касающиеся физиологической основы системы питания PLADO, ее клинической эффективности, преимуществ и потенциальных недостатков, с целью предоставления всеобъемлющего ресурса для клинической работы.
ВВЕДЕНИЕ
С увеличением продолжительности жизни растет и распространенность различных хронических неинфекционных заболеваний (ХНИЗ), включая хроническую болезнь почек (ХБП). Эта прогрессирующая почечная патология зачастую развивается при таких коморбидных состояниях, как сахарный диабет (СД), артериальная гипертензия (АГ), метаболический синдром [1, 2]. По данным опубликованного систематического анализа за 1990–2017 гг., в мире было выявлено 697,5 млн (95% доверительный интервал (ДИ): 649,2–752,0) случаев ХБП всех стадий, что соответствует глобальной распространенности в 9,1% (95% ДИ: 8,5–9,8) [3].
Патогенез ХБП охватывает разнонаправленный спектр повреждений почек [4]. Последствия негативного воздействия мультипатогенетических факторов ХБП отражаются на здоровье костной (деминерализация и повышение вероятности переломов костей) и сердечно-сосудистой систем (кальцификация сосудов, возрастание риска кардиоваскулярных катастроф) [5]. Ожидается, что увеличение доли стареющего населения с наличием ХБП преумножит затраты системы здравоохранения на эффективные стратегии лечения ХНИЗ [6].
Эксперты выделяют целый ряд модифицируемых алиментарно-зависимых факторов риска прогрессирования ХБП; среди них АГ, СД, дислипидемия, гиперурикемия, ожирение, табакокурение и др. [7]. Таким образом, подбор лечебного питания при ХБП занимает особую терапевтическую нишу в комплексном лечении. В определенных случаях сама структура коморбидности при ХБП требует от врача рекомендовать пациенту взаимоисключающие позиции. К примеру, согласно современной классификации кардио-рено-метаболического синдрома, одной из целей терапии в данном случае служит снижение жировой массы [7]. При этом в условиях реальной клинической практики представляет сложность одновременное внесение в рацион достаточного количества овощей и фруктов (риск развития гиперкалиемии) и уменьшение квоты белка (риск саркопении) [8, 9].
До настоящего времени продолжается поиск наиболее оптимального рациона для пациентов с ХБП, и все большее внимание привлекает модель питания PLADO (Plant – DOminant low-protein diet).
Цель настоящего обзора – проанализировать существующие данные о роли и эффективности низкобелковой модели питания PLADO при ХБП. Для его написания авторами проводились поиск и анализ научных источников информации, в том числе оригинальных статей, в базах данных PubMed и eLibrary, опубликованных с 2015 по 2025 г. Литературный поиск осуществлялся 27.08.2025 с использованием следующих ключевых слов: PLADO-рацион / PLADO-nutrition; хроническая болезнь почек / chronic kidney disease; растительные модели питания при ХБП / plant-based nutrition in CKD; белковое питание при ХБП / protein nutrition in CKD. Среди изученных нами работ мы отобрали 26 полнотекстовых публикаций, основанных на доказательной, экспериментальной и клинической базе и посвященных наиболее современным вопросам рационализации питания у пациентов с ХБП. Также в тексте приведены ссылки на работы, опубликованные ранее 2015 г., но содержащие значимые научные факты.
ВЛИЯНИЕ БЕЛКА НА ФУНКЦИЮ ПОЧЕК
Основной механизм влияния белка на работу почек объясняется изменением активности мезангиальных клеток, увеличением уровня трансформирующего фактора роста-β (TGF-β), прогрессированием фиброза и апоптоза подоцитов [10]. В свою очередь, длительная гломерулярная гиперфильтрация на фоне высокобелковой пищи приводит к дополнительному повреждению почек и снижению их функции, особенно в условиях ХБП (рис. 1).
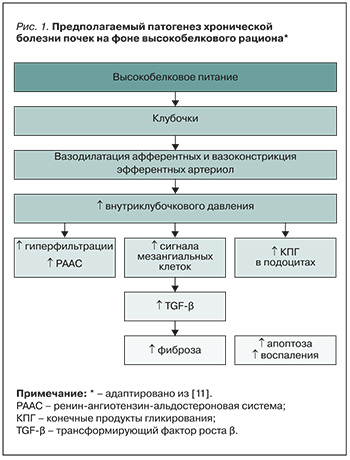
Высокое потребление белка может ускорять апоптоз подоцитов, а после термической обработки протеинсодержащей пищи значимо возрастает уровень конечных продуктов гликирования (КПГ), что ухудшает деградацию белка, вызывая утолщение базальной мембраны и мезангиальное расширение в клубочках у людей с СД и ХБП [11]. Повышенная фильтрация аминокислот и глюкозы приостанавливает клеточный цикл подоцитов и мезангиальных клеток, активируя их апоптоз в эксперименте in vitro. Через рецепторы КПГ происходят индукция клеточного воспаления и гибель клеток, а ингибирование рецепторов КПГ запускает обратный процесс [11].
В связи с этим в последнее время все чаще обсуждается вопрос о наиболее подходящем стиле питания для людей, страдающих ХБП, и главное, о качественных и количественных характеристиках потребляемого белка.
В соответствии с клиническими рекомендациями экспертов KDIGO (Kidney Disease: Improving Global Outcomes), рекомендуемое суточное потребление белка у взрослых с ХБП С3–5 составляет 0,8 г/кг/сут. [12]. В когортных и небольших рандомизированных контролируемых исследованиях продемонстрировано замедление траектории снижения скорости клубочковой фильтрации (СКФ), уменьшение риска развития терминальной почечной недостаточности, риска смертности и улучшение качества жизни на фоне питания с преимущественным содержанием растительных источников белка (например, DASH-диеты и...











