Фарматека №9 / 2025
Современные подходы к диагностике и терапии метастатического трижды-негативного рака молочной железы
Клиника высоких медицинских технологий им. Н.И. Пирогова, Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Метастатический трижды-негативный рак молочной железы (мТНРМЖ) характеризуется агрессивным течением и ранее ограниченными вариантами лечения. Однако в последние годы парадигма его терапии претерпела революционные изменения, сместившись от неспецифической химиотерапии к персонализированному подходу, основанному на биомаркерах. В данном обзоре подробно анализируются современные стратегии диагностики и лечения мТНРМЖ. Подчеркивается критическая важность всестороннего молекулярного тестирования, включая определение статуса PD-L1, герминальных мутаций в генах BRCA1/2 и экспрессии HER2 (включая HER2-низкий статус), для выбора оптимальной тактики. В данной статье акцент делается на стратегической последовательности назначения различных классов таргетных препаратов с учетом механизмов их действия и точек приложения. Статья предоставляет не только информацию о доступных опциях, но и практический алгоритм для принятия решений, основанный на последних данных доказательной медицины и четкой иерархии биомаркеров.
Для цитирования: Лазакович А.А., Джелялов Э.С., Середа О.А., Вац А.Б., Шайхелисламова Л.Ф., Журов А.С., Ахмедов Р.М., Семилетова Ю.В., Белоусов А.М., Дашян Г.А. Современные подходы к диагностике и терапии метастатического трижды-негативного рака молочной железы. Фарматека. 2025;32(9):207-216. DOI: https://dx.doi.org/10.18565/pharmateca.2025.9.207-216
Вклад авторов: Все авторы внесли существенный вклад в разработку концепции и подготовку статьи, прочли и одобрили финальную версию перед публикацией. Наибольший вклад распределен следующим образом: А.А. Лазакович, О.А. Середа, Л.Ф. Шайхелисламова – получение данных для анализа, анализ полученных данных, написание статьи. Г.А. Дашян, А.М. Белоусов, Э.С. Джелялов – научная консультация, редактирование статьи. Р.М. Ахмедов, А.С. Журов, А.Б. Вац, Ю.В. Семилетова – обзор публикаций по теме статьи.
Конфликт интересов: Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Финансирование: Работа выполнена без спонсорской поддержки.
Диагностика. Комментарии
Введение
Метастатический трижды-негативный рак молочной железы (мТНРМЖ), характеризующийся отсутствием экспрессии рецепторов эстрогена, прогестерона и амплификации гена HER2, представляет собой наиболее агрессивный и клинически гетерогенный подтип заболевания. На его долю приходится около 15–20% всех случаев рака молочной железы (РМЖ), при этом он ассоциирован с более молодым возрастом манифестации, высоким риском висцеральных метастазов и значительно худшим прогнозом по сравнению с другими молекулярными подтипами [1].
Исторически основу лечения мТНРМЖ составляла системная химиотерапия (ХТ), однако ее эффективность была ограниченной, а время до прогрессирования – коротким. Отсутствие конкретных мишеней делало этот подтип «сложным» для разработки таргетных препаратов. Переломный момент наступил с углубленным пониманием биологии ТНРМЖ, в частности роли нарушений репарации ДНК и взаимодействия между опухолью и микроокружением. Это привело к идентификации прогностических и предиктивных биомаркеров, которые кардинально изменили алгоритмы лечения [2].
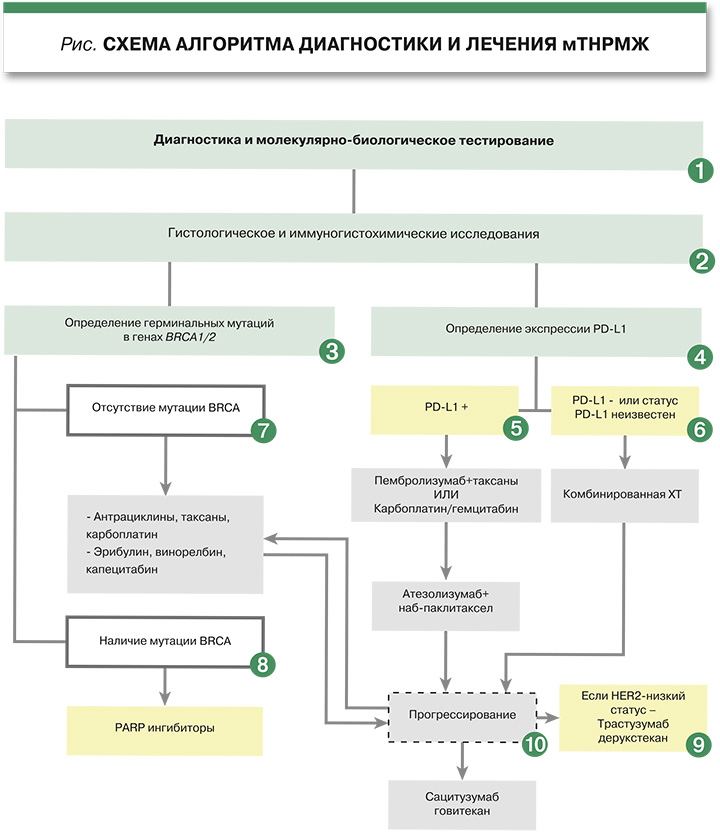
Современная стратегия ведения пациентов с мТНРМЖ неразрывно связана с обязательным всесторонним молекулярно-биологическим тестированием. Ключевыми биомаркерами, определяющими выбор терапии первой линии, являются статус PD-L1, позволяющий выделить пациентов, для которых иммунотерапия в комбинации с ХТ демонстрирует значимое улучшение выживаемости и наличие герминальных мутаций в генах BRCA1/2, открывающее доступ к высокоэффективным ингибиторам PARP [3]. Кроме того, появление концепции HER2-низкого статуса и новых антитело-конъюгатов, таких как трастузумаб-дерукстекан и сацитузумаб говитекан, расширило арсенал средств для последующих линий лечения, предлагая новые возможности для персонализированного подхода [4, 5].
Целью данной статьи является систематизированный обзор и анализ современных международных рекомендаций по диагностике и лечению мТНРМЖ. Основное внимание уделяется алгоритмизированному выбору терапии (схема) на основе результатов биомаркерного тестирования, что имеет первостепенное значение для практикующих онкологов.
Диагностика и молекулярно-биологическое тестирование при мТНРМЖ
Современная диагностика мТНРМЖ не ограничивается подтверждением фенотипа. Она перешла в парадигму обязательного углубленного молекулярно-биологического тестирования, результаты которого напрямую определяют выбор оптимальной линии терапии и, следовательно, прогноз пациента.
Подтверждение трижды-негативного фенотипа
Верификация трижды-негативного статуса является обязательным первоначальным этапом, требующим тщательного иммуногистохимического (ИГХ) исследования и при необходимости флуоресцентной гибридизации in situ (FISH – fluorescence in-situ hybridization).
Согласно современным международным рекомендациям (ASCO/CAP – American Society of Clinical Oncology/College of American Pathologists) статус рецепторов эстрогена (ER) и прогестерона (PR) считаются негативным при доле позитивно окрашенных опухолевых клеток менее 1% [6]. Наличие даже слабой позитивности (1–10%) может ассоциироваться с иным биологическим поведением и ответом на терапию, однако такие случаи часто классифицируются и лечатся как ТНРМЖ.
HER2 статус. Отрицательный статус определяется как ИГХ 0 или 1+, либо ИГХ 2+ при отсутствии амплификации гена HER2 по данным FISH (отношение HER2/CEP17<2,0 со средним числом копий гена HER2 на клетку <4,0) [7].
Только после однозначного подтверждения трижды-негативного фенотипа правомочен переход к расширенному биомаркерному тестированию.
Обязательное тестирование герминальных мутаций в генах BRCA1/2
Тестирование на герминальные мутации в генах BRCA1 и BRCA2 является стандартом для всех пациентов с мТНРМЖ (уровень доказательности I, A) [8]. Это обусловлено двумя ключевыми причинами:
- – прогностическое и профилактическое значение: наличие мутации указывает на наследственный синдром, что важно для самого пациента (риск развития рака второй молочной железы, яичников) и для его кровных родственников;
- – предиктивное значение для выбора терапии: мутации BRCA1/2 приводят к дефектам гомологичной рекомбинационной репарации ДНК, что делает опухолевые клетки высокочувствительными к ингибиторам поли(АДФ-рибоза)-полимеразы (PARP). Ключевые клинические исследования фазы III (OlympiAD, EMBRACA) продемонстрировали значительное улучшение выживаемости без прогрессирования (ВБП) при применении олапариба и талазопариба у пациентов с мТНРМЖ и герминальной мутацией BRCA по сравнению со стандартной ХТ [9, 10]. Таким образом, выявление мутации является прямым показанием к назначению терапии PARP-ингибитором в первой или последующей линии лечения.
Определение экспрессии PD-L1 как клю...












