Терапия №6 / 2016
АНЦА-ассоциированные системные васкулиты в клинической практике
1 ФГБОУ ВО «Нижегородская государственная медицинская академия», кафедра госпитальной терапии им. В.Г. Вогралика,
г. Нижний Новгород;
2 ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко», г. Нижний Новгород
Диагностика AНЦА-ассоциированного системного васкулита, включающего легочно-почечный синдром, остается сложной задачей. Она основана на выявлении циркулирующих аутоантител к цитоплазме нейтрофилов (АНЦА) и характерных гистологических изменений сосудистой стенки. В индукции и поддерживающей терапии используются комбинации иммуносупрессивных препаратов (высоких доз циклофосфамида, глюкокортикостероидов), азатиоприна, в исследованиях показана эффективность ритуксимаба. В статье рассматривается клинический случай микроскопического полиангиита.
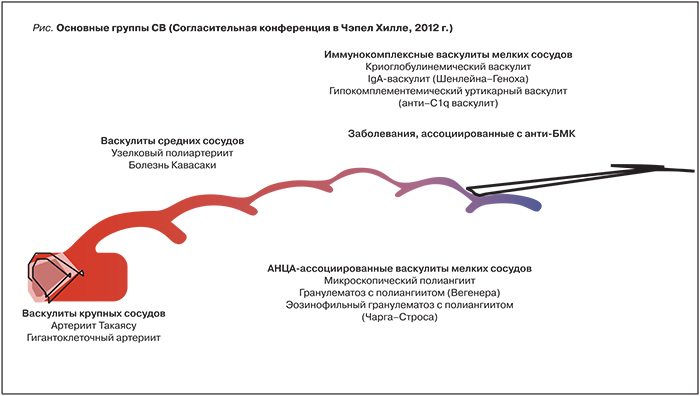
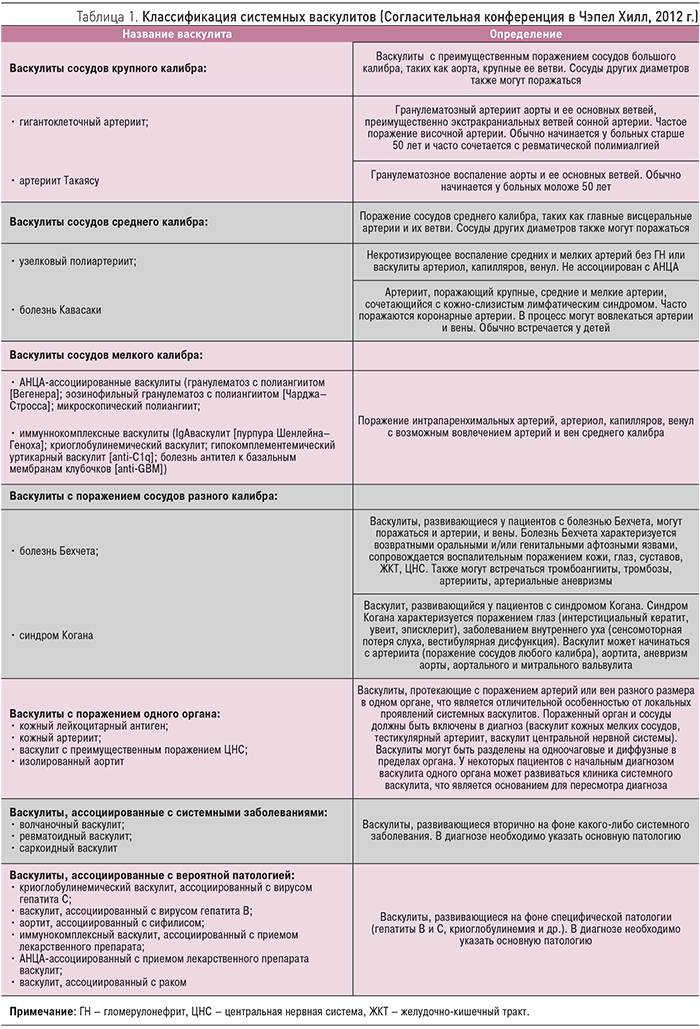
Системные васкулиты (СВ) – гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а клинические проявления определяются типом, калибром, локализацией пораженных сосудов и тяжестью иммуновоспалительных изменений [1]. Современная классификация СВ, принятая в 2012 г. на Согласительной конференции в Чэпел Хилл (Chapel Hill, USA), выделяет основные группы СВ в зависимости от калибра пораженных сосудов (крупные, средние, мелкие) и учитывает особенности иммунных механизмов (табл. 1, рисунок) [2].
AНЦА-ассоциированные СВ (АНЦА-СВ) характеризуются наличием циркулирующих аутоантител к цитоплазме нейтрофилов (АНЦА) и хроническим мало(пауци)иммунным воспалением стенки мелких сосудов с разнообразной клинической картиной с частым вовлечением легких и почек [1–4]. AНЦА представляют собой гетеpогенную группу аутоантител, реагирующих с антигенами, находящимися в цитоплазме нейтрофилов и лизосомах моноцитов. При непрямой иммунофлюоресцентной микроскопии или с помощью иммуноферментного анализа определяют антитела нейтрофилов к протеиназе-3 (цитоплазматические с-АНЦА) и к миелопероксидазе (перинуклеарные p-АНЦА) [4]. АНЦА напрямую воздействуют на клетки-мишени (нейтрофилы, моноциты) за счет связывания с антигенами (протеиназы-3, миелопероксидазы) на поверхности клеточной мембраны и вызывают активацию нейтрофилов в пределах сосудистого эндотелия. Активация нейтрофилов, их дегрануляция с высвобождением кислородных радикалов и протеолитических ферментов имеет центральное значение в повреждении сосудистой стенки с развитием некротизирующего васкулита [2, 4, 5]. Некротизирующее воспаление с формированием гранулем, развивающееся в сосудах мелкого калибра различных органов, обусловливает тяжесть поражения при АНЦА-СВ. Отсутствие иммунных депозитов и потребления комплемента при АНЦА-СВ породило термин «пауцииммунные, или малоиммунные», хотя это не означает отсутствие иммунологических расстройств в патогенезе [6].
В течение последних лет в лечении АНЦА-СВ наметился значительный прогресс. Это связано не только с расширением возможностей лабораторной диагностики АНЦА-СВ, что позволяет начать активную терапию в ранней стадии заболевания, но и с разработкой новых генно-инженерных биологических препаратов [4, 7]. Вместе с тем, несмотря на внедрение современных лабораторных и инструментальных методов, диагностика АНЦА-СВ остается затруднительной для врачей различных специальностей, что обусловлено полиорганностью поражения и многообразием клинической картины [1, 2, 4, 5] (табл. 2).
За последние десятилетия в мире отмечена тенденция к увеличению распространенности АНЦА-СВ [2–4]. Ежегодная заболеваемость АНЦА-СВ составляет 10–20 на 1 млн в год [2, 3] и различается по регионам. В России, как и в странах Европы, ГПА встречается значительно чаще, чем МПА и ЭГПА, в то время как в Японии, наоборот, выше распространенность МПА [4]. Пик заболеваемости приходится на 45–55 лет, мужчины болеют чаще, чем женщины.
В этиологии АНЦА-СВ, которая продолжает изучаться, вероятно, определенную роль играют носительство золотистого стафилококка (при ГПА), лекарственная терапия (при ЭГПА), полиморфизм генов, кодирующих протеиназу-3 и ее основной ингибитор α1-антитрипсин (SERPIN A1), предрасполагающий к гиперпродукции антител к протеиназе-3 [2, 4].
Поражение почек характерно для всех AНЦА-СВ, но частота вовлечения почек неодинакова: максимальна при МПА (90%) и ГПА (80%), значительно более редка при ЭГПА (20–45%). Клинические проявления поражения почек включают быстропрогрессирующий ГН – наиболее типичный вариант течения, нефротический синдром, остронефритический синдром, бессимптомную протеинурию и микрогематурию, макрогематурию (редко), артериальную гипертензию [4, 6]. ГН в рамках АНЦА-СВ характеризуется очаговым и сегментарным некротизирующим воспалением с выраженной экстракапиллярной реакцией с формированием полулуний в клубочках почек разной степени зрелости [1, 2, 4, 5, 7, 8]. Характерными внепочечными проявлениями АНЦА-СВ являются следующие [1, 2, 4, 5, 8]:
- Поражения ЛОР-органов, глаз, полости рта:
- геморрагический васкулит (ГВ) и МПА – кровянистые выделения из носа, средний отит, мастоидит, поражение придаточных пазух, эписклерит, увеит, кератит;
- ГВ – язвы полости рта, перфорации носовой перегородки, седловидная деформация носа, стеноз трахеи, протрузия глазного яблока, окклюзия сосудов глазного дна;
- МПА – атрофия слизистой (без признаков гранулематозного воспаления);
- ЭГПА – аллергический ринит, полипоз.












