Фарматека №7 / 2021
Абемациклиб – уникальный представитель класса ингибиторов CDK 4/6 в лечении HR+/HER2-метастатического рака молочной железы
1) Московский клинический научный центр им. А.С. Логинова, Москва, Россия;
2) Московский государственный университет им. М.В. Ломоносова, Москва, Россия;
3) Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, Москва, Россия;
4) Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва, Россия;
5) Российская медицинская академия непрерывного профессионального образования, Москва, Россия
Абемациклиб – последний из зарегистрированных представителей класса ингибиторов циклинзависимых киназ-4 и -6 (iCDK4/6), обладающий уникальными фармакокинетическими свойствами, обусловливающими его высокую эффективность в лечении пациенток с HR+/HER2- метастатическим раком молочной железы (мРМЖ). Регистрационными исследованиями стал цикл MONARCH, оценивавший эффективность терапии абемациклибом в монорежиме, в комбинации с фулвестрантом (во 2-й линии) и ингибиторами ароматазы (в 1-й линии лечения). Продемонстрирована потенциальная эффективность терапии абемациклибом у пациенток с интракраниальным метастатическим поражением. Спектр, частота встречаемости и выраженность нежелательных явлений (НЯ), наблюдаемых при терапии абемоциклибом, несколько отличается от характерных для палбоциклиба и рибоциклиба, однако и эти НЯ поддаются коррекции и редко являются причиной отмены терапии. В данной статье рассмотрены клинические данные об эффективности и безопасности применения абемациклиба.
Введение
В начале 2000-х гг. в мировой литературе появились первые публикации о влиянии циклинзависимых киназ (CDK) на пролиферацию опухолевых клеток и о возможности ингибирования CDK в рамках потенциальной противоопухолевой терапии [1].
Известно, что CDK4/6 участвуют в клеточном цикле, способствуя переходу клетки из фазы G1, фазы митоза, в синтетическую S-фазу путем образования комплекса с циклином D1 (CycD1) и фосфорилирования белка Rb (рис. 1). В опухолевых клетках CDK4/6 обладают патологической активностью и выступают в качестве драйверов клеточной пролиферации, что приводит к их бесконтрольному размножению.
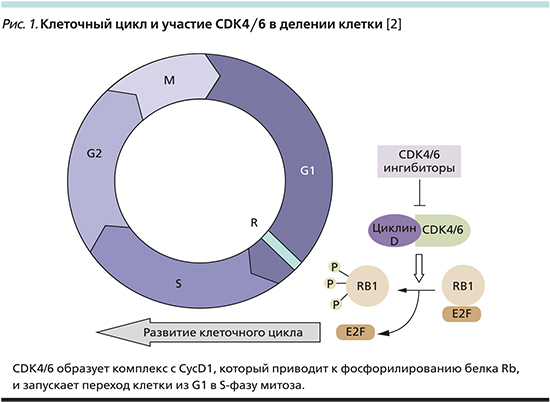
В экспериментах in vitro было показано, что эстрадиол запускает клеточную пролиферацию, воздействуя на уже обозначенные CDK и циклины. Так, в эксперименте O.W. Prall et al. клетки культуры рака молочной железы (РМЖ), обработанные антагонистами эстрогена, впадали в арест клеточного цикла на фазе G1 [3]. Таким образом, дополнительно блокируя переход из G1- в S-фазу, можно добиться дополнительного противоопухолевого эффекта. Впервые синергизм iCDK4/6 и эндокринотерапии был продемонстрирован in vitro R.S. Finn et al. на примере комбинации палбоциклиба и тамоксифена [4]. Также было показано, что нарушение регуляции комплекса CDK4/6-CycD1-Rb приводит к развитию эндокринорезистентности (ЭР) [5]. Именно поэтому ингибиторы CDK4/6 (iCDK4/6) привлекли пристальное внимание исследователей в качестве терапии люминального HER2-негативного (HR+/HER2-) РМЖ.
На сегодняшний день в Российской Федерации зарегистрировано три пероральных препарата класса iCDK4/6: рибоциклиб (цикл регистрационных исследований MON-ALEESA), палбоциклиб (цикл PALOMA) и абемациклиб (цикл MONARCH).
Согласно современным рекомендациями по лечению РМЖ, iCDK4/6 рассматриваются в качестве наиболее предпочтительной опции 1-й или 2-й линии лечения HR+/HER2-метастатического РМЖ (мРМЖ).
В 2019 г. опубликованы данные крупного мета-анализа, в котором M. Giuliano et al. проанализировали данные 140 исследований II и III фаз, сравнивавших химио- (ХТ) и эндокринотерапию в лечении HR+/HER2- мРМЖ [6]. Авторы приходят к выводу, согласно которому ни один режим ХТ не превосходит комбинацию iCDK4/6 и эндокринотерапии по показателю выживаемости без прогрессирования (ВБП) при значимо более благоприятном профиле токсичности.
Абемациклиб: уникальность молекулы
Абемациклиб – последний из зарегистрированных пероральных iCDK4/6, который обладает некоторыми фармакокинетическими особенностями, отличающими его от других представителей рассматриваемого класса [7]. Он уникален высокоселективным ингибированием комплексов CDK4/CycD1 (концентрация полумаксимального ингибирования (IC50=2 нмоль/л) и CDK6/CycD1 (IC50=10 нмоль/л), при этом не связывается с другими CDK (кроме CDK9). При этом афинность абемациклиба к CDK4 в 14 раз выше, чем к CDK6 [8]. По сравнению с другими препаратами класса селективность в отношении CDK4/CycD1 у абема-циклиба значительно выше, чем у палбоциклиба и рибоциклиба (показатель IC50 у абема-циклиба в 5 раз ниже) [9].
Помимо активности в клеточном цикле S. Goel et al. продемонстрировали иммуномодулирующие свойства абемациклиба путем потенцирования презентации опухолевых антигенов и селективной супрессии регуляторных Т-лимфоцитов. В моделях трансгенных мышей абемациклиб моделирует микроокружение опухолевых клеток, стимулирует выработку интерферонов III типа и связанных с ними транскрипционных факторов (таких, как STAT1/2, IRF2/6,9, NLRC5). Также отмечено уменьшение числа регуляторных Т-лимфоцитов, обладающих иммуносупрессивным действием, в селезенке и лимфатических узлах, при этом число цитотоксических CD8+ Т-лимфоцитов оставалось неизменным. Полученные данные могут косвенно свидетельствовать о стимуляции иммунного ответа при применении абемациклиба [10].
Применение абемациклиба в монотерапии предлеченных пациенток с HR+/HER2- мРМЖ: исследование MONARCH-1
По результатам исследований эффективности применения палбоциклиба и рибоциклиба в монотерапии предлеченных пациенток с HR+/HER2- мРМЖ, опуболикованных в 2015 и 2016 гг., ни один из изучаемых препаратов не продемонстрировал клинического преимущества [10–12].
Однако результаты исследования MONARCH-1 изменили представление о применении iCDK4/6 в монорежиме [13]. В указанном исследовании изучали применение абемациклиба в монотерапии у предлеченных пациенток с HR+/HER2- мРМЖ. Дизайн предполагал включение пациенток, получивших не менее двух линий лечения по поводу HR+/HER2- мРМЖ и имевших признаки ЭР.
В исследовании 132 пациентки получали монотерапию абемациклибом в дозе 200 мг 2 раза в сутки (каждые 12 часов). Первичной конечной точкой исследования стала оценка частоты объективного ответа (ЧОО), вторичными – общая выживаемость (ОВ), ВБП и безопасность терапии.
Как уже было отмечено, в исследование включались предлеченные пациентки: среднее число линий системной терапии составило 5 (от 2 до 11), а по поводу метастатической болезни – 3 (от 1 до 8). При эт...












