Терапия №2 / 2018
Аммиак – актуальная проблема врача и пациента в терапевтической практике
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» (МГМСУ) Минздрава России, Москва
В статье представлены научные данные о роли аммиака в развитии и прогрессировании заболеваний печени. Освещены вопросы фиброзообразования в печени и роли в нем звездчатых клеток печени. Особое место уделено патогенетическим подходам лечения при гипераммониемии. Приведены данные об эффективности препарата L-орнитин-L-аспартат (Гепа-Мерц) у больных с неалкогольной жировой болезнью печени.
Аммиак является одним из важнейших нейротоксических метаболитов в организме человека. Хорошо известно, что повышение концентрации аммиака сопровождается развитием дисбаланса аминокислот в головном мозге с преобладанием ароматических с разветвленной цепью. Последствием гипераммониемии является отек астроглии, изменения постсинаптических рецепторов и процессов нейротрансмиссии, нарушения проницаемости гематоэнцефалического барьера и снижение энергетического обеспечения нейронов. Степень выраженности клинических проявлений этих нарушений напрямую коррелирует с уровнем аммиака в сыворотке крови, а уровень аммиака, в свою очередь, определяется состоянием детоксицирующей функции печени [1, 2].
Печень ‒ орган, который одновременно является источником аммиака и местом его обезвреживания. Аммиак в организме человека образуется преимущественно из азота пищевого белка в ходе реакций дезаминирования аминокислот в печени. Детоксикация осуществляется преимущественно в митохондриях перипортальных гепатоцитов за счет связывания с аминокислотами в орнитиновом цикле и образованием нетоксичной мочевины, а также в реакции образования глутамина с участием глутаминсинтетазы. Очевидно, что гипераммониемия развивается в организме человека прежде всего при хронических заболеваниях печени (ХЗП) вследствие нарушения ее детоксицирующей функции из-за снижения активности ферментов орнитинового цикла и глутаминсинтетазной реакции [1, 2].
В клинической практике наиболее частым проявлением гипераммониемии является печеночная энцефалопатия (ПЭ) при различной патологии печени. Под ПЭ понимают спектр нервно-психических расстройств, развивающихся в результате острой или хронической печеночно-клеточной недостаточности и/или портосистемном шунтировании крови [2]. В зависимости от выраженности нарушений деятельности головного мозга выделяют четыре степени тяжести печеночной энцефалопатии (табл.).
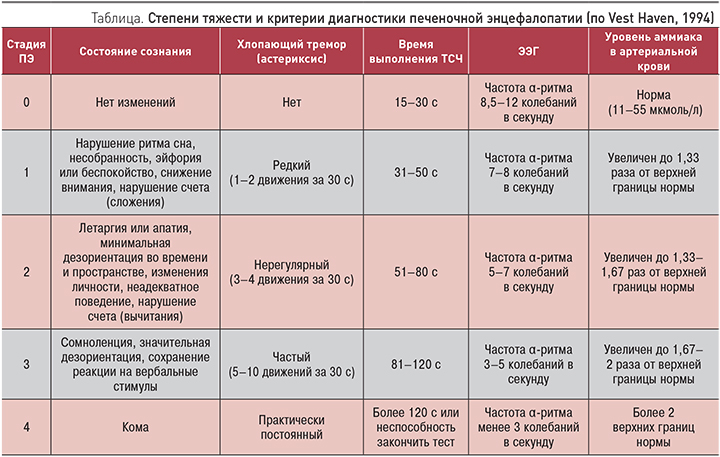
Очевидно, что выраженные нарушения когнитивных функций выявить легко, однако на самых ранних стадиях гипераммониемии явных клинических признаков патологии нет. Минимальную (латентную) ПЭ можно диагностировать, только используя специальные опросники или методы, например, метод выполнения теста связи чисел (ТСЧ) или метод вызванных потенциалов головного мозга, для проведения которого необходимо иметь специальный аппарат. При этом выявляются разнообразные когнитивные и психомоторные расстройства: трудности с принятием решений, снижение скорости психомоторных реакций и др. Неспецифическими клиническими симптомами латентной ПЭ могут быть повышенная утомляемость, слабость, раздражительность, инверсия сна (сонливость днем и бессонница ночью), нарушения речи, изменения почерка, рассеянность за рулем и при выполнении работы, требующей повышенной концентрации внимания, тремор, снижение мышечных рефлексов. Результатом таких нарушений могут стать серьезные дорожно-транспортные происшествия с тяжелыми последствиями [3, 4]. В связи с этим выявление минимальной ПЭ имеет большое значение у работников многих профессий: водителей автотранспорта, операторов на автоматизированном оборудовании и др.
В 2016 г. были опубликованы результаты исследования, которые показали, что гипераммониемия токсична не только для астроцитов. Получены данные о том, что повышение уровня аммиака дозозависимо активирует звездчатые клетки печени (ЗКП) и стимулирует коллагенообразование [5]. Звездчатые клетки печени активируются под влиянием различных факторов (алкоголя, вирусов, лекарств, холестаза и др.), при этом они приобретают сократительные, провоспалительные и профиброгенные свойства, т.е. трансформируются в миофибробластоподобные клетки. При этом из пролиферирующих ЗКП исчезают хранящиеся в них в покое запасы ретинола и появляется специфический белок гладких мышц (α-актин), одновременно увеличивается количе...












