Фарматека №18 (271) / 2013
Антигипоксантная терапия в комплексном патогенетическом лечении дистрофических заболеваний позвоночника
Городское медицинское объединение, нейрохирургическое отделение, Самарканд
Целью данного исследования послужила оценка эффективности применения Актовегина больными с неврологическими проявлениями поясничного остеохондроза. В исследование были включены 60 пациентов с синдромом острой вертеброгенной люмбоишиалгии (32 мужчины, 28 женщин в возрасте от 30 до 60 лет). Вертеброневрологическая диагностика проведена по критериям H. Hall. Больные были разделены на 2 группы: 1-я группа – 30 пациентов, получавших традиционное комплексное консервативное лечение и внутривенное капельное переливание 20 % Актовегина; 2-я группа – 30 пациентов, получавших только традиционное комплексное консервативное лечение (без Актовегина). Балльная оценка результатов лечения осуществлена врачом, динамика боли оценена пациентом по визуальной аналоговой шкале, количественная оценка вертебрального синдрома проведена с помощью шкалы G. Waddel и соавт.
Анализ отечественной и международной литературы показал, что ни мануальная, ни физиотерапия, ни тракция позвоночника, а также другие консервативные методы лечения дистрофических заболеваний (остеохондроз) позвоночника, рекомендованные Всемирной организацией здравоохранения, не решили проблемы [14].
Недостаточная эффективность существующих консервативных способов лечения пациентов с неврологическими проявлениями остеохондроза позвоночника указывают на следующее: среди существующих способов консервативного лечения нет такого, который ликвидировал бы основной патогенетический элемент данного заболевания – катаболический метаболизм в межпозвонковом диске (МПД), развивающийся вследствие энергетической недостаточности в хондроцитах [1, 3–10, 13–17, 20, 27]. В связи с этим разработка новых способов патогенетического лечения остеохондроза позвоночника перспективна и актуальна.
В настоящее время установлено, что основной причиной развития энергетической недостаточности в хондроцитах МПД является недостаточное нутриентное обеспечение (нехватка глюкозы, аминокислот, кислорода и воды) [18, 23, 24, 28] вследствие перемещения склеротического процесса из собственных сосудов МПД на сосуды, снабжающие тела позвонков [4–6, 9, 10, 18, 23, 24, 28]. H.A. Horner и J.P.G. Urban [23], исследуя выживание клеток диска в различных условиях, доказали, что если адекватное количество кислорода и глюкозы не поступает в ткани МПД, переключение метаболизма на анаэробный гликолиз приводит к развитию энергетической недостаточности (при анаэробном гликолизе образуется всего 200 кДж/моль энергии и 2 молекулы АТФ по сравнению с аэробным – 2800 кДж/моль энергии и 38 молекул АТФ) [1, 12–14, 27]. Энергии, образовавшейся в результате анаэробного гликолиза, недостаточно для продолжения жизнедеятельности клеток МПД. Для того чтобы поддерживать свою жизнедеятельность, клетки МПД используют энергию, образовавшуюся в результате поэтапного расщепления более крупных молекул матрикса протеогликанов (белково-мукополисахаридный комплекс) на протеин (аггрекан) и глюкозоаминогликаны (мукополисахариды). На фоне продолжающейся энергетической недостаточности происходит катаболический метаболизм: белки расщепляются до дезаминированных аминокислот, глюкозоаминогликаны – до моносахаридов. Энергия, образованная в результате катаболического метаболизма, лишь частично покрывает энергетическую потребность клеток, поэтому разрушение матрикса медленно и незаметно прогрессирует [18, 23, 24, 28].
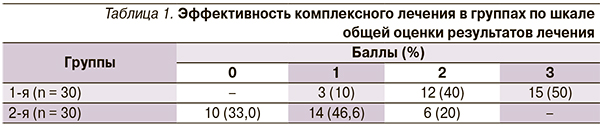
Вышеизложенное показывает, что при...












