Клиническая Нефрология №3 / 2013
Антикоагуляция на гемодиализе: перспективы применения низкомолекулярных гепаринов в оптимизации диализа
1 ГБУЗ «Городская Мариинская больница» - Городской нефрологический центр, Санкт-Петербург; 2 Северо-Западный ГМУ им. И.И. Мечникова, кафедра внутренних болезней и нефрологии Вишневский К.А., Герасимчук Р.П. – врачи отделения диализа СПб ГБУЗ «Городская Мариинская больница»
Представлено значение низкомолекулярных гепаринов для антикоагуляции при гемодиализе; приведены результаты собственных клинических исследований, демонстрирующих их преимущества перед нефракционированным гепарином.
Проблема адекватной антикоагуляции во время процедуры гемодиализа имеет столь же длительную историю, как и сама история заместительной почечной терапии. При проведении первых процедур гемодиализа в клинической практике в 1924 г. немецкий врач Джордж Хаас в качестве антикоагулянта применял ингибитор тромбина гирудин, который имеет выраженную антигенную активность и вызывает прежде всего пирогенную реакцию, что не обеспечивало должной безопасности данной процедуры. В 1927 г. Джон Хаас впервые применил во время процедуры гемодиализа гепарин, и это стало началом новой эры в развитии заместительной почечной терапии.
Процесс тромбообразования в экстракорпоральном гемодиализном контуре связан с активацией каскада свертывающей системы плазмы крови и тромбоцитов. Контактная активация высокомолекулярных белков плазмы кининогена и прекаликреина приводит к последующей активации фактора XII. Фактор XIIа активирует фактор XI, который в свою очередь активирует фактор IX, образующий комплекс с активированным фактором VIII. В то же время активация периферических лейкоцитов и моноцитов способствует высвобождению мощных источников тканевого фактора, связывающегося с активированным фактором VII. Комплекс IXa–VIIIa совместно с комплексом ТФ–VIIа активирует фактор X. Конверсия протромбина в тромбин происходит после активации кофактора V, а тромбин конвертирует фибриноген в фибрин, который при полимеризации образует нерастворимый тромб. Так как активированный фактор X в свою очередь активирует фактор VII, а тромбин – фактор XI, происходит усиленная активация фактора X, занимающего центральное место в каскаде [1, 2] (см. рисунок).
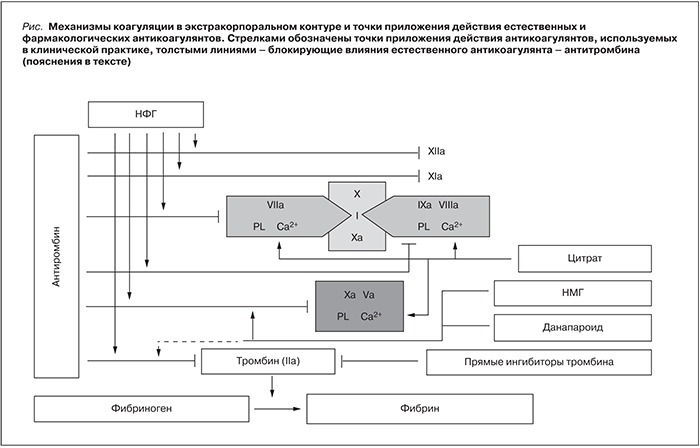
Антикоагуляционный эффект нефракционированного гепарина (НФГ) связан с активацией антитромбина, являющегося естественным антикоагулянтом, связывающим некомплексный активированный фактор II (тромбин), активированные факторы X, IX и XI, но преимущественно его действие обусловлено связыванием факторов II и X. Молекулярная масса большинства фармакологических НФГ – около 12–15 кДа, и они содержат около 45 высокосульфатированных сахаридных групп. НФГ вырабатывают из слизистой оболочки кишечника свиней или из легких крупного рогатого скота.
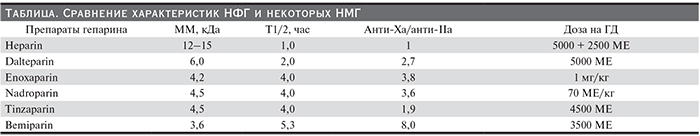
Низкомолекулярные гепарины (НМГ) получают путем обработки НФГ химически или ферментативно с целью уменьшения длины полисахаридных цепей, в результате чего получаются препараты с ограниченным молекулярно-массовым распределением – как правило, около 5 кДа. Например, эноксапарин получают обработкой НФГ химически – путем бензилирования с последующей щелочной деполимеризацией, а тинзапарин вырабатывается путем ферментативной деполимеризации НФГ гепариназой. В отличие от НФГ, который одинаково ингибирует активированный фактор X и тромбин, НМГ имеют значительно большую активность в отношении фактора X. Отношение активности анти-Ха к анти-IIа является одной их характеристик различных НМГ и определяет их антитромботическое действие (см. таблицу). Меньшее воздействие на активность тромбина позволяет рассчитывать на меньшую выраженность серьезных геморрагических осложнений. На текущий момент наибольшее значение анти-Ха/анти-IIa среди НМГ имеет бемипарин натрия – препарат Цибор®, производство Испании (только данапароид имеет больший коэффициент – 22, но он не является, строго говоря, НМГ и отсутствует на российском рынке). Он также характеризуется наименьшим молекулярным весом и наибольшим временем полужизни [3].
Это различие в точках приложения антикоагуляционной активности НФГ и НМГ определяет и различие в способах оценки эффективности и выбора дозы. НФГ дозируется по достижению увеличения активированного частичного тромбопластинового времени (АЧТВ). Считается, что в начале диализа удлинение должно составлять 80 % от исходной величины (25–40 секунд), в конце сеанса...












