Кардиология №10 / 2015
Ассоциация артериальной гипертензии, осложненной гипертрофией миокарда и сердечной недостаточностью, с более низкими уровнями фактора роста эндотелия сосудов (VEGF-A165) в сыворотке крови
1ФГБУ ДПО Центральная государственная медицинская академия Управления делами Президента РФ, Москва; 2ГБУЗ Городская клиническая больница №17 Департамента здравоохранения г. Москвы; 3ГБУЗ Городская клиническая больница №51 Департамента здравоохранения г. Москвы; 4ФГБУ Федеральный научно-клинический центр специализированных видов клинической помощи и медицинских технологий ФМБА России, Москва
Известно, что гипертрофия миокарда левого желудочка (ГЛЖ) у больных артериальной гипертензией (АГ) достоверно повышает риск развития сердечно-сосудистых осложнений, в частности сердечной недостаточности (СН).
На начальных этапах развития ГЛЖ при АГ сохраняется нормальная архитектоника миокарда, так как вслед за увеличивающимися в размере кардиомиоцитами увеличивается и количество сосудов микроциркуляторного русла [1].
Но затем относительная плотность капиллярной сети снижается, наступает несоответствие между количеством сосудов микроциркуляторного русла и размером кардиомиоцитов, что приводит к хронической гипоксии миокарда [1—3].
Фактор роста эндотелия сосудов (vascular endothelial growth factor —VEGF) — сигнальный белок, играющий ключевую роль в регуляции ангиогенеза. Процесс ангиогенеза у взрослого человека происходит в течение всей жизни, когда появляется необходимость в дополнительной васкуляризации.
У человека установлено 5 вариантов VEGF: A, B, C, D и плацентарный фактор роста. Самым распространенным и изученным является VEGF-A. Он запускает неоангиогенез, повышает проницаемость сосудов, приводит к миграции клеток, а также препятствует апоптозу клеток эндотелия [4].
Ген VEGF-A кодирует синтез различных по длине белковых молекул VEGF-A. Так, число аминокислот в молекуле VEGF-A может быть равным 121, 145, 165, 183, 189 и 206 [5]. Большинство молекул VEGF-A165 привязаны к клеточным поверхностям и экстрацеллюлярному матриксу, но часть из них в свободной форме находится в кровотоке [6]. Вероятно поэтому, именно данная изоформа наиболее активна и приспособляема при различных физиологических и патологических состояниях, а также перспективна в качестве биомаркера периферической крови.
 Накоплено достаточно данных в исследованиях in vitro и на животных, проясняющих молекулярные механизмы развития гипертрофии и ремоделирования миокарда при АГ. Доказано независимое негативное влияние появления гипертрофии миокарда на прогноз у больного АГ. Теперь требуется выработка стратификационного подхода к пациенту с ГЛЖ, в котором использовались бы не только визуальные методы оценки, но и биохимические маркеры гипертрофии.
Накоплено достаточно данных в исследованиях in vitro и на животных, проясняющих молекулярные механизмы развития гипертрофии и ремоделирования миокарда при АГ. Доказано независимое негативное влияние появления гипертрофии миокарда на прогноз у больного АГ. Теперь требуется выработка стратификационного подхода к пациенту с ГЛЖ, в котором использовались бы не только визуальные методы оценки, но и биохимические маркеры гипертрофии.
Несмотря на обширные экспериментальные данные, демонстрирующие вовлеченность VEGF в процессы развития и декомпенсации гипертонического сердца [1, 7, 8], подобных клинических исследований у пациентов с АГ и ГЛЖ не проводилось.
Целью нашей работы было изучение взаимосвязи уровня VEGF-A165 в периферической крови у больных АГ с ГЛЖ и СН.
Материал и методы
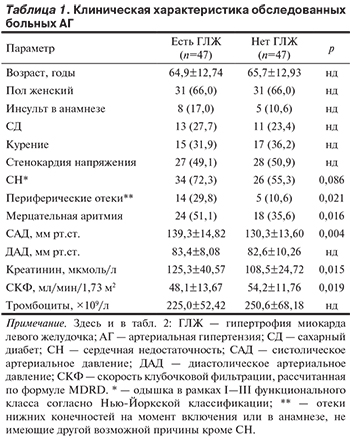
Обследованы 47 больных с установленным при эхокардиографии (ЭхоКГ) утолщением стенок левого желудочка (ЛЖ).
К ним подобрана группа контроля из 47 человек с нормальной толщиной стенок ЛЖ, сопоставимых по возрасту и полу.
Больные находились на стационарном лечении в кардиологическом отделении ГБУЗ «Городская клиническая больницы №17» ДЗ Москвы. ГЛЖ диагностировалась при ЭхоКГ.
Критериями включения были толщина миокарда ЛЖ 16 мм и более, отсутствие патологии (крупноочагового инфаркта миокарда или миокардита в анамнезе), приводящей к нарушению локальной сократимости миокарда ЛЖ или снижению фракции выброса (ФВ) ЛЖ, согласие больного на использование данных в научных целях. В исследование не включали больных с клинически значимой клапанной патологией, а также больных с онкопатологией в течение 5 лет до включения.
Трансторакальную ЭхоКГ проводили на ультразвуковом аппарате с мультичастотным фазированным датчиком 3S-RS (1,7—4,0 МГц). Основные позиции двухмерного изображения записывались из парастернального доступа по длинной и короткой осям и верхушечного доступа на 2 (А2С), 4 (А4С) камеры и по длинной оси (LAX). В дальнейшем применялся стандартный протокол исследования, рекомендованный Американской ассоциацией ЭхоКГ [9]. Определение конечного диастолического (КДО) и конечного систолического (КСО) объемов ЛЖ, а также КСО левого предсердия (ЛП) проводили методом дисков, расчет ФВ ЛЖ по формуле: ФВ ЛЖ=(КДО-КСО)/КДО×100%.
Масса миокарда ЛЖ рассчитывалась по формуле Devereux: 0,8×[1,04×(МЖП+КДР+ЗСЛЖ)3-КДР3]+0,6, где КДР — конечный диастолический размер ЛЖ, МЖП — толщина межжелудочковой перегородки в диасто...












