Акушерство и Гинекология №7 / 2016
Ассоциация экспрессии генов в кумулюсных клетках c эмбриологическими показателями в программах вспомогательных репродуктивных технологий
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Поиск молекулярно-генетических маркеров для оценки качества ооцитов, эмбрионов с высоким потенциалом к развитию с целью повышения эффективности лечения бесплодия с помощью методов ВРТ.
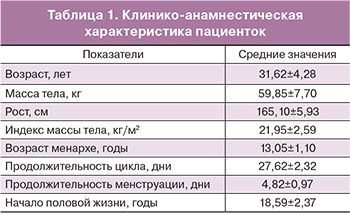
Материал и методы. В ходе проведенного исследования были проанализированы 89 образцов кумулюсных клеток от 39 пациенток, проходивших программу ЭКО (ИКСИ). Полученные эмбрионы были разделены на 3 группы в зависимости от морфологической оценки качества эмбрионов. I группа – эмбрионы хорошего качества (51 образец), II группа - эмбрионы удовлетворительного качества (19 образцов), III группа - эмбрионы неудовлетворительного качества (19 образцов). Был исследован уровень экспрессии мРНК 7 генов в кумулюсных клетках методом ОТ-ПЦР в режиме реального времени: гиалуронан-синтетазы-2 (HAS2), простагландина синтетазы-2 (PTGS2), гена гремлина (GREM1), версикана (VCAN), амфирегулина (AREG), инозитол-трифосфат-3-киназы-А (ITPKA), молекулы клеточной адгезии активированных лейкоцитов (ALCAM или CD166).
Результаты. Выявлена взаимосвязь уровня экспрессии гена СD 166 (ALCAM) и показателей качества эмбрионов. Данная взаимосвязь выявлена при сравнении эмбрионов хорошего и плохого качества (р=0,008). При этом не было выявлено статистически значимых различий между качеством перенесенных эмбрионов и показателем наступления клинической беременности (p=0,856).
Заключение. Ген ALCAM может являться потенциальным предиктором оценки качества эмбрионов согласно морфологическим критериям оценки. Дальнейшее изучение экспрессии генов в кумулюсных клетках поможет идентифицировать потенциальные биомаркеры для оценки качества ооцитов, эмбрионов и, таким образом, позволит в дальнейшем оптимизировать выбор переносимых эмбрионов и тем самым повысить результативность программ ЭКО в целом.
Распространенность бесплодия среди супружеских пар репродуктивного возраста растет, достигая 15%. Среди всех доступных методов лечения бесплодия вспомогательные репродуктивные технологии (ВРТ) имеют самые высокие показатели наступления беременности и рождения живых детей. Сегодня, по оценкам экспертов, 2–3% всех родов в развитых странах являются результатом программ ВРТ [1].
Однако, несмотря на широкое применение программ ВРТ для лечения бесплодия и увеличивающееся с каждым годом количество пациентов, проходящих программу ЭКО, процент эффективности лечения остается достаточно низким [2].
Целью стимуляции овуляции при проведении программ ЭКО является получение большого количества ооцитов для снижения риска неудач путем выбора наиболее приемлемого эмбриона для переноса [3, 4].
Выбор эмбриона с высоким имплантационным потенциалом является одним из ведущих факторов успешного лечения бесплодия при использовании ВРТ [5]. В настоящее время оценка эмбрионов в основном основывается на морфологических критериях и скорости дробления клеток. Однако, точность такого метода отбора эмбрионов остается недостаточно высокой, хотя его использование и привело к значительному повышению результативности программ ЭКО [6]. Таким образом, развитие точных и малоинвазивных объективных методов оценки качественных ооцитов и жизнеспособных эмбрионов является одной из наиболее важных направлений репродуктивной медицины.
Достаточно многообещающе выглядят исследования последнего десятилетия, показывающие возможность оценки качества ооцитов по состоянию окружающих его клеток, получаемых при выделении кумулюс- ооцитарного комплекса после пункции фолликула.
Кумулюсные клетки, непосредственно окружающие ооцит, образуются в процессе фолликулогенеза на этапе формирования полости внутри фолликула из низкодифференцированных предшественников – клеток гранулезы [7]. Основным фактором дифференцировки клеток-предшественников кумулюса является изменение соотношения ФСГ/ЛГ в плазме крови[7]. Кумулюсные клетки тесно связанны с ооцитом посредством специальных щелевых контактов, позволяющих осуществлять метаболический обмен и транспорт сигнальных молекул [8]. Ооцит, в свою очередь, продуцирует растворимые факторы роста (ооцит секретируемые факторы (OSF)), необходимые для роста окружающих фолликулярных клеток на разных этапах развития. Эти факторы роста регулируют различные функции гранулезных и кумулюсных клеток, включающие дифференцировку, пролиферацию, апоптоз и лютеинизацию [7]. Таким образом, связь между ооцитом и кумулюсными клетками является двунаправленной: кумулюсные клетки ответственны за развитие и созревание ооцитов, а ооциты, в свою очередь, играют важную роль в пролиферации и развитии окружающих их фолликулярных клеток [9].
 Так как кумулюсные клетки постоянно реагируют на изменения, происходящие в интрафолликулярной среде с целью обеспечения оптимального развития ооцитов, информацию о состоянии ооцита можно получать посредством обнаружения молекулярно-генетических изменений в кумулюсных клетках. Например, модели экспрессии определенных генов отражают процессы, происходящие в клетке в данный момент времени, в том числе и ответ клеток на различные воздействия окружающей среды. Таким образом, анализ экспрессии генов в кумулюсных клетках может выявить данные об условиях внутри фолликула и качестве полученных ооцитов, определяя их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию.
Так как кумулюсные клетки постоянно реагируют на изменения, происходящие в интрафолликулярной среде с целью обеспечения оптимального развития ооцитов, информацию о состоянии ооцита можно получать посредством обнаружения молекулярно-генетических изменений в кумулюсных клетках. Например, модели экспрессии определенных генов отражают процессы, происходящие в клетке в данный момент времени, в том числе и ответ клеток на различные воздействия окружающей среды. Таким образом, анализ экспрессии генов в кумулюсных клетках может выявить данные об условиях внутри фолликула и качестве полученных ооцитов, определяя их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию.
Цель исследования: поиск молекулярно-генетический маркеров для оценки качества ооцитов, эмбрионов с высоким потенциалом к развитию с целью повышения эффективности лечения бесплодия с помощью методов ВРТ.
Материал и методы исследования
На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено ретроспективное исследование случай-контроль.
Был исследован уровень экспрессии мРНК 7 генов в кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени: гены внеклеточного матрикса (гиалуронан-синтетаза 2 (HAS2), версикан (VCAN), молекула клеточной адгезии активированных лейкоцитов (ALCAM или CD166)), а также гены, регулирующие передачу внутриклеточной информации (простагландин синтетаза 2 (PTGS2), гремлин (GREM1), амфирегулин (AREG), инозитол-трифосфат 3 киназы А (ITPKA)) (реактивы ДНК-Технология, Россия).












