Кардиология №6 / 2016
Аутоиммунитет и прогноз у больных с морфологически документированным миокардитом
ФГБУ Северо-Западный федеральный медицинский исследовательский центр им. В.А. Алмазова Минздрава РФ, Санкт-Петербург
Цель исследования. Оценить клиническое и прогностическое значение циркулирующих кардиоспецифических аутоантител (ААТ) и Т-регуляторных клеток CD4+ у больных миокардитом. Материал и методы. В исследование были включены 47 пациентов
с лимфоцитарным миокардитом, документированным на основании анализа гистологических и иммуногистохимических данных. В качестве группы сравнения обследованы 30 практически здоровых лиц. У всех пациентов определяли содержание маркерных кардиотропных ААТ с помощью стандартизованных иммуноферментных тест-систем группы ЭЛИ-ТЕСТ. Число циркулирующих Т-лимфоцитов CD4+CD25+ и CD4+CD25+FoxP3+ оценивали методом проточной цитометрии. Результаты. Среди факторов, определяющих прогноз больных лимфоцитарным миокардитом, ключевое значение имели клинически выраженная сердечная недостаточность в дебюте заболевания, а также степень снижения фракции выброса левого желудочка. Отличительной особенностью больных активным миокардитом было повышение титра ААТ к саркомерным, цитоскелетным и цитоплазматическим белкам кардиомиоцитов, а также уровня ААТ к различным эпитопам белка — переносчика адениновых нуклеотидов ANT. Повышенный уровень ААТ к β1-адренорецепторам был независимым предиктором развития неблагоприятного исхода у больных лимфоцитарным миокардитом. Увеличение популяции циркулирующих Т-регуляторных клеток CD4+CD25+ сопряжено с повышением концентрации натрийуретического пептида. Заключение. Нарушения в системе аутоиммунитета играют ключевую роль не только в патогенезе,
но и в прогнозе воспалительных заболеваний миокарда. Изменения профиля циркулирующих кардиоспецифических аутоантител
и Т-регуляторных клеток могут носить защитную функцию.
Несмотря на достижения последних десятилетий, диагностика воспалительных заболеваний миокарда по-прежнему вызывает большие трудности, что в первую очередь связано с разнообразием их клинических проявлений. Кроме того, как следует из определения, данного группой экспертов Всемирной организации здравоохранения (1996), миокардит — это, прежде всего, морфологический диагноз, что дополнительно подчеркивает важность проведения эндомиокардиальной биопсии (ЭМБ) для верификации диагноза [1].
Современные представления о патогенезе воспалительных заболеваний миокарда неразрывно связаны с понятием аутоиммунитета. Дополнительным подтверждением аутоиммунной природы миокардита служат такие проявления заболевания, как персистирующая при отсутствии инфекционного агента воспалительная инфильтрация в миокарде, повышение титра циркулирующих кардиоспецифичных аутоантител (ААТ) и в ряде случаев – эффективность иммуносупресивной терапии. При иммуногистохимическом исследовании биоптатов миокарда у больных миокардитом в 59% случаев выявляются специфические ААТ [2]. Вместе с тем циркулирующие антимиокардиальные антитела не являются патогномоничным признаком миокардита и могут определяться у 9—57% больных дилатационной кардиомиопатией (ДКМП), у 9,3% пациентов с острым коронарным синдромом, у 27,6% – с систолической дисфункцией миокарда ишемического генеза и даже у 2—25% практически здоровых лиц [2—4]. Несмотря на низкую специфичность, выявление повышенного титра циркулирующих кардиоспецифических ААТ, как правило, ассоциировано с неблагоприятным прогнозом течения миокардита или ДКМП, а также с более высоким риском развития заболевания у здоровых родственников больных ДКМП [5, 6].
Однако ключевое значение в патогенезе миокардита играет не гуморальный, а клеточный иммунный ответ и, прежде всего, опосредованная главным комплексом гистосовместимости II класса CD4+Т-зависимая лимфоцитарная реакция [7].
В связи с этим особый интерес представляет популяция Т-регуляторных клеток CD4+CD25+, которые участвуют в поддержании иммунологической аутотолерантности и иммунного гомеостаза, подавляя аномальный иммунный ответ.
В какой степени профиль циркулирующих кардиоспецифических ААТ и количество Т-регуляторных клеток CD4+CD25+ отражают тяжесть морфологических и иммуногистохимических изменений у больных лимфоцитарным миокардитом и как это связано с клиническими проявлениями заболевания? На эти вопросы мы попытались ответить в настоящей работе.
Цель исследования: оценить клиническое и прогностическое значение циркулирующих кардиоспецифических ААТ и Т-регуляторных клеток CD4+ у больных миокардитом.
Материал и методы
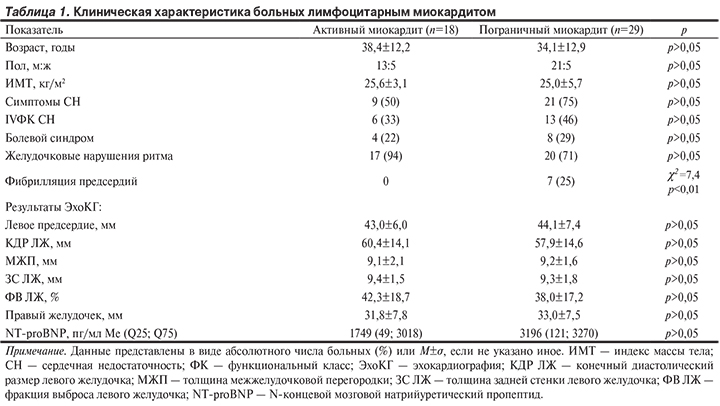
Исследование проводилось на базе ФГБУ «СЗФМИЦ им. В.А. Алмазова» с сентября 2011 по ноябрь 2013 г. и носило проспективный характер. Обследованы 47 пациентов с лимфоцитарным миокардитом, документированным на основании анализа гистологических и иммуногистохимических данных в соответствии с утвержденными положениями Рабочей группы по заболеваниям миокарда и перикарда Европейского общества кардиологов [8]. В исследуемую группу вошли 18 больных активным и 29 пациентов с пограничным лимфоцитарным миокардитом.
Контрольную группу составили 30 практически здоровых лиц, доноров крови (17 мужчин, 13 женщин, средний возраст 33,8±9,3 года).
Исследование было одобрено этическим комитетом ФГБУ «ФМИЦ им. В.А. Алмазова». Перед включением в исследование все пациенты подписывали информированное согласие. Клиническая характеристика групп представлена в табл. 1.
Всем пациентам проводили ЭхоКГ на аппарате Vivid 7 (GE, США), определяли размеры камер сердца, толщину межжелудочковой перегородки в диастолу, толщину задней стенки левого желудочка (ЛЖ) в диастолу, фракцию выброса (ФВ) ЛЖ по Симпсону.
Биоптаты миокарда фиксировали 10% забуференным формалином. Парафиновые срезы 2—3 мкм окрашивали гематоксилином и эозином по ван Гизону и азур-эозином для оценки воспалительных инфильтратов. Дополнительно выполняли ШИК-реакцию для исключения гликогенозов, а также окраску конго красным и окраску по Перлсу для исключения амилоидоза и гемохроматоза у пациентов старше 50 лет [9].

Для выявления воспалительных изменений в миокарде проводили иммуногистохимическое исследование с антителами к HLA-DR (clone LN3, Leica, 1:300), CD-3 (поликлональные антитела, DAKO, 1:800), CD45 (clone 2B11+PD7/26, DAKO, 1:1200), CD-68 (clone PG-M1, DAKO, 1:1000). Экспрессию HLA-DR оценивали в баллах: 1 балл — экспрессия антигена на единичных клетках воспалительного инфильтрата; 2 балла — на всех клетках инфильтрата; 3 балла — на всех клетках инфильтрата и на эндотелии некоторых сосудов; 4 балла — на всех клетках инфильтрата, на эндотелии всех сосудов и вдоль всех капилляров. Активный миокардит диагностировали при наличии некроза кардиомиоцитов и воспалительного инфильтрата, включающего не менее 14 лейкоцитов на 1 мм2, из них ...












