Кардиология №9 / 2014
Азилсартан — новый представитель класса блокаторов рецепторов к ангиотензину II
ГОУ ВПО « Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава РФ, 127473 Москва, ул. Делегатская, 20/1; ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава РФ
Статья представляет собой обзор литературных данных об эффективности и переносимости нового представителя класса блокаторов рецепторов к ангиотензину II (БРА) азилсартана, зарегистрированного к применению в РФ в 2014 г. Установлено, что данный препарат обладает преимуществом по сравнению с рядом других представителей класса БРА (валсартаном, олмесартаном, кандесартаном) и ингибитором АПФ рамиприлом в виде более мощного антигипертензивного эффекта.
Основная цель лечения больных артериальной гипертонией (АГ) — максимальное снижение риска развития сердечно-сосудистых осложнений (ССО) и смерти от них [1].
Для достижения этой цели, прежде всего, требуется снижение артериального давления (АД) до целевого уровня — менее 140/90 мм рт.ст. [1].
В настоящее время для лечения больных АГ рекомендованы 5 основных классов антигипертензивных препаратов (АГП): ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина II 1-го типа (БРА), антагонисты кальция, β-адреноблокаторы, диуретики [1]. На выбор препарата влияют многие факторы, наиболее важными из которых считают [1]:
- наличие у больного различных факторов риска;
- наличие поражения органов-мишеней;
- ассоциированные клинические состояния, поражения почек, сахарный диабет (СД);
- сопутствующие заболевания, при которых необходимо назначение или ограничение применения АГП различных классов;
- предыдущие индивидуальные реакции больного на препараты различных классов;
- вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам;
- социально-экономические факторы, включая стоимость лечения.
 При выборе АГП необходимо в первую очередь оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации [1].
При выборе АГП необходимо в первую очередь оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации [1].
Уменьшение риска развития ССО на фоне АГТ в большей степени зависит от величины, на которую снижается АД, чем от используемого класса АГП, и невозможно точно прогнозировать, какой АГП будет максимально эффективен у конкретного пациента [1]. При назначении любого из основных классов АГП есть свои «за» и «против», поэтому универсальное ранжирование АГП является ненужным и, скорее всего, опасным [1]. В каждой конкретной клинической ситуации необходимо учитывать особенности действия различных классов АГП, обнаруженные при проведении рандомизированных исследований. Однако очень часто даже представители одного класса имеют особые свойства, которые делают их назначение более обоснованным. Выбор того или иного АГП, особенно в начале лечения, должен основываться на результатах клинических исследований, в которых доказаны высокая эффективность и безопасность применения именно этого препарата у пациентов в подобной клинической ситуации [1].
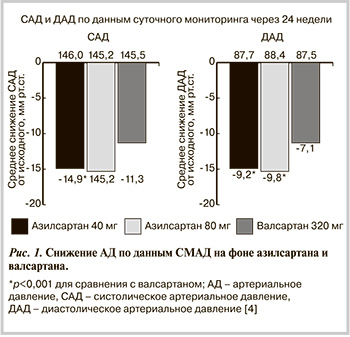
Одним из 5 основных классов АГП являются БРА. В действии ангиотензина II (АТII) на сосуды различают два механизма — прессорный и депрессорный [1, 2]. Первый опосредуется влиянием АТII на рецепторы 1-го типа (АТ1) и приводит к вазоконстрикции, задержке натрия и жидкости, увеличению симпатической активности, снижению тонуса блуждающего нерва, пролиферации клеток и положительному инотропному эффекту. Депрессорное действие АТII реализуется через стимуляцию рецепторов 2-го типа (АТ2), что приводит к вазодилатации, особенно выраженной в сосудах головного мозга и почек, натрийуретическому действию, антипролиферативному эффекту, активации кининогена, высвобождению оксида азота и простагландина I2. В основе антигипертензивного действия и других фармакологических эффектов блокаторов рецепторов АТ1 лежат прямой механизм и два косвенных. Первый связан с ослаблением эффектов АТII в условиях селективной блокады рецепторов АТ1. Второй обусловлен реактивной гиперактивацией ренин-ангиотензин-альдостероновой системы (РААС) в условиях блокады рецепторов АТ1 и дополнительной стимуляцией рецепторов АТ2. На антигипертензивную эффективность БРА не влияют активность РААС, пол и возраст пациента. У БРА нет «ускользания» антигипертензивного эффекта, так как их действие не зависит от пути образования АТII [1, 2]. Для БРА доказано положительное влияние на состояние органов-мишеней и снижение риска развития всех ССО. Помимо того, для БРА характерна наиболее высокая приверженность пациентов лечению за счет высокой эффективности и наилучшей среди всех классов АГП переносимости лечения [1, 2]. За последние годы показания к применению БРА существенно расширились. К ранее имевшимся показаниям (диабетическая нефропатия, протеинурия/микроальбуминурия, хроническая сердечная недостаточность, гипертрофия миокарда левого желудочка, мерцательная аритмия, кашель при приеме ингибиторов АПФ и т.д.) добавились такие, как ишемическая болезнь сердца, недиабетическая нефропатия, дисфункция левого желудочка, пожилой возраст [1].
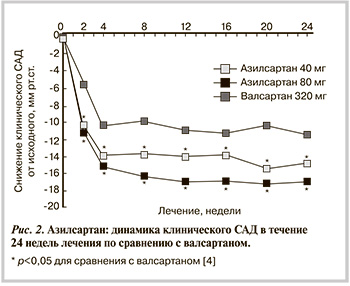 До настоящего время класс БРА включал лозартан, валсартан, кандесартан, телмисартан, ирбесартан, эпросартан, олмесартан. Сейчас в Российской Федерации зарегистрирован к применению азилсартан. Азилсартан медоксомил (эдарби, Такеда) — пролекарство, которое быстро гидролизуется в организме до активного остатка азилсартана — мощного и высоко селективного БРА, подавляющего эффекты АТII [3]. Азилсартан, назначаемый 1 раз в сутки, показан к применению для лечения эссенциальной АГ в виде монотерапии или в комбинации с другими АГП. Расчетная абсолютная биодоступность эдарби после приема составляет п...
До настоящего время класс БРА включал лозартан, валсартан, кандесартан, телмисартан, ирбесартан, эпросартан, олмесартан. Сейчас в Российской Федерации зарегистрирован к применению азилсартан. Азилсартан медоксомил (эдарби, Такеда) — пролекарство, которое быстро гидролизуется в организме до активного остатка азилсартана — мощного и высоко селективного БРА, подавляющего эффекты АТII [3]. Азилсартан, назначаемый 1 раз в сутки, показан к применению для лечения эссенциальной АГ в виде монотерапии или в комбинации с другими АГП. Расчетная абсолютная биодоступность эдарби после приема составляет п...












