Эпидемиология и Инфекционные болезни. Актуальные вопросы №6 / 2013
Биохимические признаки адаптивных закономерностей при токсической дифтерии
Центральный НИИ эпидемиологии Роспотребнадзора, Москва
Цель исследования. Изучение характера биохимических сдвигов при токсической дифтерии ротоглотки в зависимости от типа возбудителя – токсигенных коринебактерий дифтерии (КБД) mitis или gravis.
Материалы и методы. В исследование включены 40 больных токсической дифтерией ротоглотки с тяжелым и среднетяжелым течением заболевания.
Результаты. В динамике наблюдения у больных установлены биохимические различия в картине заболевания в зависимости от этиологического фактора – токсигенных КБД mitis или gravis. Так, у пациентов с токсической дифтерией ротоглотки, вызванной токсигенными КБД gravis, заболевание протекало тяжелее, чаще регистрировались полиорганные нарушения (осложнения) и летальные исходы (30% случаев). Клиническая картина коррелировала с биохимическими сдвигами как в начале заболевания, так и в динамике острого периода болезни. Прогностически неблагоприятные метаболические нарушения чаще регистрировали у пациентов с токсической дифтерией, вызванной КБД gravis; они определялись уже в начале заболевания и продолжали нарастать в динамике болезни. Токсическая дифтерия, вызванная КБД mitis – клинически и биохимически более благоприятный вариант заболевания. Меньшая нагрузка метаболических систем (АСТ, АЛТ) и больший «запас прочности» (пул свободных аминокислот в крови) обеспечивают лучшую перспективу выздоровления данной группе пациентов. Биохимические сдвиги в большей степени соответствуют тяжести течения заболевания, чем устоявшийся критерий – отек подкожной клетчатки шеи.
Заключение. Токсическая дифтерия, вызванная токсигенными КБД gravis, характеризуется более тяжелым течением, чем вызванная токсигенными КБД mitis. Клиническая картина заболевания коррелирует с количественными изменениями исследуемых показателей.
Как известно, ошибки в диагностике и лечении больных токсической дифтерией в период эпидемии 1990–1998 гг. во многом были связаны с устаревшим представлением врачей о том, что основным критерием установления степени тяжести токсической дифтерии ротоглотки является размер отека подкожной клетчатки шеи [1]. Это послужило стимулом к поиску новых способов ранней диагностики тяжести инфекционного процесса, а также усовершенствованию существующей классификации [2].
В 1931 г. английские авторы (Н. Андерсон и др.) впервые предположили, что тип gravis ассоциируется с более тяжелым, а mitis – с более легким течением дифтерии. В нашем ретроспективном исследовании среди 40 больных с тяжелым и среднетяжелым течением токсической дифтерии у 30 человек заболевание было вызвано токсигенными КБД gravis (с летальным исходом в 9 случаях) и у 10 человек – токсигенными КБД mitis (все с благоприятным исходом).
В настоящее время факторы патогенности КБД, внутривидовые различия штаммов и дифтерийный токсин (ДТ) настолько подробно изучены, что мы рискнули вернуться к поиску взаимосвязей между этиологическим фактором (штаммом КБД), тяжестью течения и изменениями биохимического статуса пациентов при поступлении (1–4-й день болезни) и в динамике (7–12-й день болезни). В инфекционной практике достаточно примеров, описывающих клинические особенности течения болезни в зависимости от внутривидовых различий возбудителя (дизентерия, сальмонеллез и др.), однако при эпидемическом подъеме заболеваемости дифтерией в 1990–1998 гг. таких наблюдений мы не обнаружили [3].
Следует заметить, что возбудитель дифтерии обладает весьма выразительным набором факторов патогенности: его составляют адгезины, ферменты агрессии и экзотоксин – один из наиболее сильных бактериальных токсинов. Коринебактерии демонстрируют высокие адгезивные свойства к эпителиальным и неэпителиальным клеткам (за счет образования белковых пилей разной длины) и способны к гемагглютинации и аутоагглютинации. Гемолизин КБД активно лизирует эритроциты, а фибриноген-связывающий фактор позволяет возбудителю превращать фибриноген в фибрин, минуя традиционный каскад свертывания. Это качество объясняет уникальную способность КБД формировать плотную фибриновую пленку в первичном очаге поражения. Вероятно также, что быстро развивающаяся тромбоцитопения, гемолиз эритроцитов, как и клинически развёрнутая картина геморрагической дифтерии – не только следствие острого тромбогеморрагического синдрома, но и результат действия гемолизина КБД [4].
Коринекомиколат клеточной стенки обеспечивает некоторую устойчивость КБД к фагоцитозу и препятствует перевариванию дифтерийной палочки внутри фагоцитов. Возбудитель сохраняет жизнеспособность вплоть до момента гибели фагоцита [2]. Эта способность бактерии обеспечивает ей выживание в активном периоде антибактериальной терапии и создает предпосылки для длительной циркуляции возбудителя в организме [2].
Создается впечатление, что КБД – хорошо подготовленный микроорганизм-кровопийца. Будучи условным анаэробом, он активно внедряется в ткань миндалин – зону высокого кровоснабжения, формирует там себе «крышу» – плотную фибриновую пленку, под которой он защищен от действия местных антисептических средств и кислорода, и использует белок, кровь (эритроциты, железо) макроорганизма для собственной жизнедеятельности.
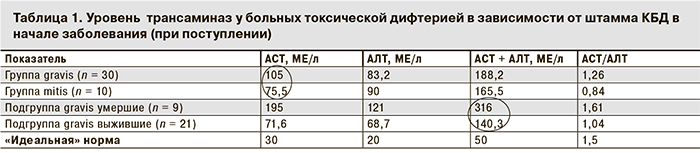
Как известно, КБД gravis обладает большей патогенностью. Данный биотип научился активно ферментировать не только белки, но и крахмал. Активное включение в «рацион питания» углеводов убедительно визуализируется при посеве возбудителей на кровяном агаре: колонии КБД gravis – черного цвета, значительно более крупные, «сытые», гладкие и блестящие, в отличие от более мелких и невзрачных колоний КБД mitis.
Хотя способность токсигенных коринебактерий gravis и mitis, как и двух других биотипов (intermedius и belfanti) синтезировать ДТ одинакова, а уровень экспрессии ДТ определяется содержанием ионов железа в цитоплазме возбудителя, нельзя исключить тот факт, что более крупные колонии gravis выделяют большее количество ДТ, гемолизина, нейраминидазы и прочих патогенов, так как способны быстрее расти.
Рецептором для дифтерийного токсина на мембране клеток человека служит гепарин-связывающий предшественник эпидермального фактора роста (ГС-ЭФР). Наибольшее количество ГС-ЭФР-рецепторов сосредоточено на клетках миокарда и в нервной ткани, в ткани почек и надпочечников, что, вероятно, объясняет избирательность поражения при дифтерии этих органов. Научные исследования доказали, что дезоксирибонуклеаза А-фрагмента ДТ осуществляет фрагментацию хромосом и инициирует апоптоз, а В-фрагмент ДТ инактивирует фактор элонгации полипептидной цепи (eEF2), что сопровождается необратимым блокированием синтеза белка и гибелью пораженной токсином к...












