Клиническая Нефрология №4 / 2014
Биомаркеры поражения почек у больных артериальной гипертензией с гиперурикемией: персонифицированный подход к оценке прогноза
Кафедра внутренних, профессиональных болезней и пульмонологии медико-профилактического факультета, ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава РФ.
Цель. На основании изучения экскретируемых с мочой биомаркеров тубулоинтерстициального повреждения (МСР-1
и β2-МГ), уровня системных и локально-почечных маркеров эндотелиальной дисфункции (МАУ, ЭТ-1) определить факторы прогрессирования поражения почек у больных АГ с НОМК для оценки прогноза и выбора оптимальной тактики ведения.
Материал и методы. Обследован 81 пациент с АГ 1-й степени без ассоциированных клинических состояний, сахарного диабета, метаболического синдрома. Выделено три группы исследования: группа 1 – с гиперурикозурией
(n = 7) , группа 2 – с гиперурикемией (n = 53), группа 3 – с гиперурикемией и почечной недостаточностью (n = 6). Контрольную группу составили 15 пациентов с АГ без нарушения обмена мочевой кислоты, сопоставимых по возрасту и полу с группами исследования.
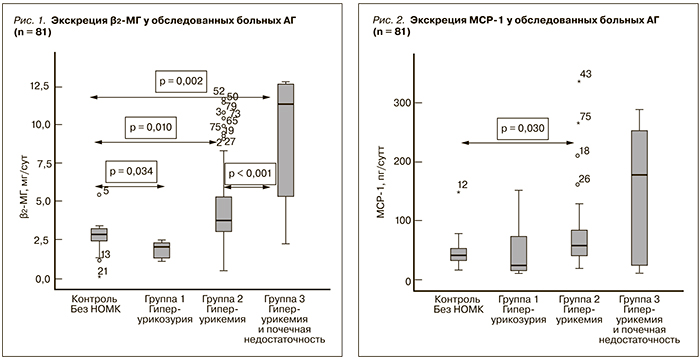
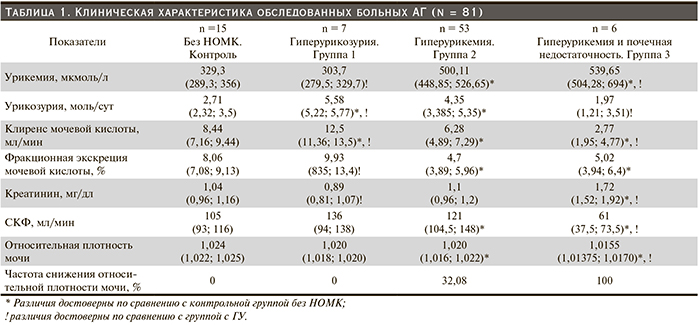
Результаты. По сравнению с пациентами контрольной группы у больных АГ с гиперурикемией (группа 2) отмечаются более высокие показатели МАУ (р = 0,009), экскреции с мочой β2-МГ (р = 0,010), МСР-1 (р = 0,030), а также содержания ЭТ-1 в плазме крови (р = 0,003). Обнаружены прямые корреляции между всеми изученными биомаркерами и степенью урикемии (соответственно Rs = 0,411, р < 0,001; Rs = 0,537, р < 0,001; Rs = 0,318, р = 0,004; Rs = 0,453, р < 0,001). При многофакторном анализе изученных клинико-лабораторных показателей (метод множественного линейного регресса) подтверждена роль МСР-1, β2-МГ, МАУ, уровня сывороточного креатинина как независимых предикторов снижения относительной плотности мочи – клинического признака тубулоинтерстициального повреждения/фиброза; более широкого спектра показателей – МАУ, толщины межжелудочковой перегородки, скорости клубочковой фильтрации, относительной плотности мочи, систолического артериального давления, МСР-1, липо-
протеидов низкой плотности – как факторов риска прогрессирования почечной недостаточности.
Заключение. Выявленные взаимосвязи мочевых биомаркеров МАУ, β2-МГ, МСР-1 и плазменной концентрации ЭТ-1 с биохимическими показателями и признаками поражения органов-мишеней у больных АГ с гиперурикемией позволяют персонифицировать прогноз поражения почек у данной категории пациентов.
Артериальная гипертензия (АГ) и нарушение обмена мочевой кислоты (НОМК) относятся к важным популяционно значимым проблемам внутренней медицины ввиду их широкой распространенности среди населения разных возрастных групп, в т.ч. трудоспособной его части, а также развития серьезных осложнений [1, 2].
На возможную связь гиперурикемии (ГУ) с АГ и ассоциированными с ней сердечно-сосудистыми заболеваниями указал еще в первой половине ХХ в. выдающийся отечественный клиницист Е.М. Тареев. Им было замечено, что больные уратным дисметаболизмом и суставной подагрой погибают от хронической почечной недостаточности и сердечно-сосудистых катастроф, которые у них возникают в более молодом возрасте, чем у лиц без НОМК [3].
Но еще ранее, в 1897 г., N.S. Davis указал на роль ГУ в генезе АГ и почечного поражения, предполагая гемодинамический механизм воздействия МК на повышение тонуса почечных артериол [4].
Спектр почечных осложнений АГ изучен более подробно [5], так же как методы их лечения и профилактики. В то же время варианты поражения почек, ассоциированные с НОМК, исследованы в меньшей степени. Кроме уратного нефролитиаза и достаточно редкой острой мочекислой канальцевой блокады прогностическое значение при НОМК имеет хроническое тубулоинтерстициальное поражение почек, ведущее к тубулоинтерстициальному фиброзу и почечной недостаточности [6]. При этом АГ, сочетающаяся с ГУ, может быть как причиной, так и следствием тубулоинтерстициального поражения почек [7, 8]. Показано, что гиперпродукция мочевой кислоты приводит к тубулоинтерстициальному поражению сравнительной быстро, проявляясь в первую очередь АГ [9]; с другой стороны, ГУ служит одним из факторов, ускоряющим поражение почек при эссенциальной АГ [10].
Проведенные к настоящему времени эпидемиологические исследования дают убедительные основания считать ГУ наряду с АГ и сахарным диабетом независимым общепопуляционным фактором риска хронической болезни почек (ХБП) [11–13].
При этом повреждающее действие избытка мочевой кислоты и ее солей на почечную ткань не ограничивается только их кристаллизацией в просвете почечных канальцев и интерстиции. По современным представлениям, одним из возможных сопрягающих АГ и ГУ механизмов почечного повреждения являются системная и локально-почечная эндотелиальная дисфункция, развитие эндотелиально- и эпителиально-мезенхимальной трансдифференциации с продукцией экстрацеллюлярного матрикса – основы тубулоинтерстициального фиброза [14–18].
В экспериментальных условиях показано, что при ГУ возрастает инфильтрация тубулоинтерстициальных структур макрофагами и миофибробластами, повышается экспрессия ими коллагена, остеопонтина, молекул адгезии ICAM-I, возникает депрессия локально-почечных систем фибринолиза, эти изменения частично обратимы при назначении аллопуринола [19–21]. Клинических работ данного направления недостаточно.
 В связи с этим представляют интерес исследования, выполненные в последние годы в клинике им. Е.М. Тареева, по изучению экскретируемых с мочой больных хроническим гломерулонефритом биомаркеров тубулоинтерстициального повреждения/фиброза – ТИФ (как отражения эпителиально-мезенхимальной трансдифференциации), в которых показана инф...
В связи с этим представляют интерес исследования, выполненные в последние годы в клинике им. Е.М. Тареева, по изучению экскретируемых с мочой больных хроническим гломерулонефритом биомаркеров тубулоинтерстициального повреждения/фиброза – ТИФ (как отражения эпителиально-мезенхимальной трансдифференциации), в которых показана инф...












