Фарматека №5 (258) / 2013
Биосимиляры: проблемы замещения и современные требования к воспроизведенным препаратам инсулина
Проведенные к настоящему времени исследования убедительно доказали существенные различия в эффективности и безопасности терапии между оригинальными и воспроизведенными биотехнологическими препаратами (биосимилярами). Тем не менее, несмотря на множество свидетельств терапевтической неэквивалентности, существует опасность “автоматического” замещения оригинальных препаратов на биосимиляры в связи с более низкой стоимостью. Сложившаяся ситуация требует пересмотра законодательной базы, регулирующей обращение биосимиляров в нашей стране.
Окончание срока патентной защиты на многие оригинальные биопрепараты первой генерации стало ключевым фактором разработки и широкого выхода на фармацевтический рынок биосимиляров – препаратов, которые представляют собой воспроизведенные версии оригинальных биотехнологических лекарственных средств (ЛС).
Проблемы, связанные с использованием этого нового класса ЛС, имеют непосредственное отношение к деятельности диабетологов и эндокринологов, поскольку очень многие ежедневно используемые в нашей практике препараты – инсулины и их аналоги, гормон роста (ГР), эритропоэтины (ЭПО) – относятся к генерации биотехнол огических.
Определения
Согласно определению, указанному в первых документах Европейского фармацевтического кодекса, выделивших биосимиляры в качестве отдельного класса препаратов, биосимиляр, или “подобный биологический лекарственный продукт” (“similar biological medicinal product”), – это воспроизведенное при помощи биотехнологий ЛС, сходное с оригинальным биотехнологическим ЛС и представленное
на регистрацию после истечения срока действия патента оригинального ЛС [1]. В свою очередь биотехнологическим (или биофармацевтическим) называют препарат, который содержит активное вещество, вырабатываемое или извлекаемое из биологического источника, полученное при помощи
биотехнологических методов [1], наиболее известным из которых является метод рекомбинантной ДНК.
Характеристика биотехнологических препаратов
Действующей (активной) субстанцией биотехнологических ЛС является белок. Именно в силу особых свойств белковых молекул [2–6], которых нет у небиологических веществ, класс биотехнологических ЛС принципиально отличается от обычных химических препаратов.
Рисунок 1. Размер и структура различных белков по сравнению с молекулой химического вещества (аспирина).
Большая молекулярная масса (рис. 1), сложная и очень легкоповреждаемая пространственная структура (рис. 2), посттрансляционная модификация молекулы, нестабильность белковых молекул – все эти свойства определяют наличие высокой вариабельности как структурных, так и функциональных характеристик биотехнологических ЛС.
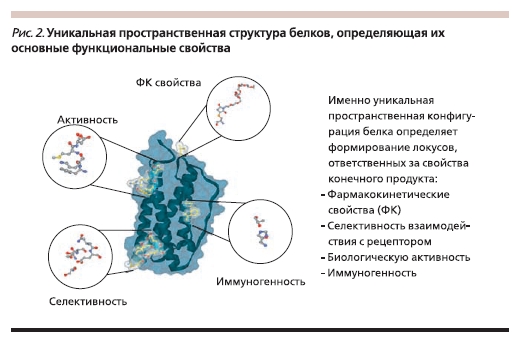
Белковые молекулы по своей природе нестабильны, их свойства могут существенно меняться вплоть до полной потери биологической активности под воздействием множества факторов. Изменение технологии на любом этапе производства – от исходных компонентов до выделения и очистки,
взаимодействие с вспомогательными субстанциями (например, стабилизатором), условия хранения – может повреждать белок и изменять его свойства.
Специфика биотехнологического производства
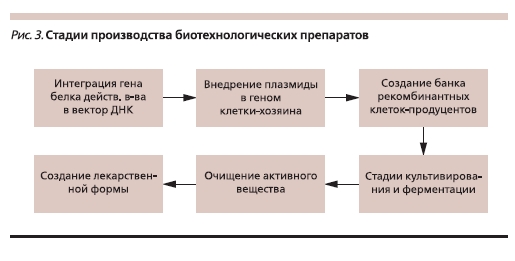
Характеристика свойств белков и производства биотехнологических препаратов (рис. 3), в т. ч. инсулинов (рис. 4), представлена в нашем предыдущем обзоре [7], поэтому мы не будем останавливаться на этом подробно. Достаточно сказать, что уже в самом термине “биосимиляры” заключены два важнейших для понимания данной концепции ключа: 1)”био” – живой, 2) “симиляр” – подобный, похожий.
Рисунок 4. Сложный многоэтапный процесс производства инсулина.
Поскольку процесс биотехнологического производства осуществляется в “живых системах” клеток (бактериях, вирусах, дрожжевых грибах), подверженных естественной и неустранимой вариабельности [3–5, 8, 9], то и продукт данного производства неизбежно вариабелен – свойство, которое получило название микрогетерогенности белков. Микрогетерогенность может проявляться даже между различными сериями препарата одного и того же производителя. Чтобы нивелировать влияние этого природного свойства белков, все используемые ингредиенты, технологические процессы, состав примесей при производстве оригинальных биопрепаратов проходят очень жесткий, многоэтапный контроль качества, обеспечивая высочайший уровень стандартизации
конечного продукта. Насколько производители биосимиляров, ориентированные на снижение стоимости и затрат на производство, могут обеспечить соответствующие стандарты качества – вопрос, который, к сожалению, не имеет однозначного ответа.
Однако даже при условии соблюдения контроля качества биосимиляр не может быть “идентичной копией” оригинального биопрепарата в силу особенностей биотехнологического производства [3–5]. Так, разработанные линии рекомбинантных клеток – продуцентов действующего вещества, как и все последующие стадии культивирования и ферментации, абсолютно уникальны для каждого биопрепарата и являются собственностью производителя оригинального бренда, т. е. предметом патента. Таким образом, существование различий между биосимилярами и оригинальными биопрепаратами неизбежно и является закономерным следствием невозможности точного воспроизведения технологии производства.
Самое важное, что последствия этих различий, особенно в отношении иммуногенности, невозможно прогнозировать [8, 10, 11]. Дело в том, что в отличие от простых молекул химических веществ, где каждый атом несет строго определенную функциональную нагрузку, структурно-функциональные взаимоотношения белков известны лишь частично [3]. При этом доступные в настоящее время лабораторные методы анализа бел...












