Урология №3 / 2017
Чрескожная криоаблация опухоли почки под ультразвуковым контролем
ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет),
НИИ уронефрологии и репродуктивного здоровья человека, Москва, Россия
Введение. «Золотым» стандартом лечения больных начальными стадиями рака почки (T1) является резекция. Однако в последнее время благодаря научному прогрессу появились новые малоинвазивные альтернативные методики. Одним из таких методов является чрескожная криоаблация.
Цель работы: оценить эффективность и безопасность чрескожной криоаблации опухоли почки под ультразвуковым контролем.
Материалы и методы. В исследовании приняли участие 12 пациентов в возрасте от 52 до 76 лет, которым выполняли чрескожную криоаблацию опухоли почки под УЗ-контролем с 2015 по 2017 г. У 11 пациентов размер образования был до 3,0 см (Т1a), у 1 пациента – 4,5 см (T1b).
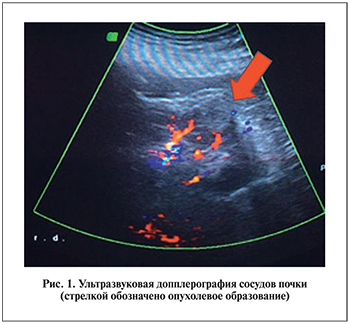
На дооперационном этапе и через 6 мес после операции всем пациентам было проведено УЗИ с допплерографией, МСКТ с контрастированием и компьютерное 3D-моделирование, которое помогало четко оценить размер опухоли, уточнить распространенность опухолевого процесса и пространственное отношение внутренней поверхности опухолевого узла к элементам чашечно-лоханочной системы. Во всех наблюдениях образования располагались по задней или латеральной поверхности почки; в нижнем или среднем сегменте; без инвазии в синус.
Мы использовали криомашину 3-го поколения SeedNet gold (Galil Medical), криозонды IceSeed и IceRod. Интраоперационно, непосредственно перед криоаблацией выполнялась биопсия опухоли, наличие почечно-клеточного рака у всех больных было подтверждено морфологически.
Результаты. Длительность криоаблации в среднем – 60 мин. Одна операция была выполнена под эндотрахеальным наркозом, 6 – под спинномозговой анестезией, 5 – под местной и 1 – под внутривенной анестезией. По данным УЗ-обследования с эходопплерографией через 6 мес после операции размер образований у 11 пациентов (Т1а) уменьшился в среднем на 8 мм, при этом в них отсутствовал кровоток. При проведении МСКТ с 3D-моделированием отмечалось также уменьшение образований и полное отсуствие накопления контрастного препарата либо их градиент накопления не превышал 10 HU (первоначально он составлял около 200 HU).
У пациента на стадии T1b по данным МСКТ отмечено уменьшение опухоли в размере с 4,5 до 3,7 см,
однако в ней определен участок до 1,5 см с высоким градиентом накопления контрастного препарата. Пациенту была проведена резекция почки.
Интра- и послеоперационных осложнений выявлено не было.
Выводы. Накопленный опыт позволяет подтвердить эффективность и безопасность перкутанной криоаблации под уз-контролем и рассматривать ее как метод выбора для пациентов с опухолью почки в стадии Т1а с локализацией по задней или латеральной поверхности в нижнем или среднем сегменте, без инвазии в синус.
Введение. Почечно-клеточный рак (ПКР) – это наиболее часто встречающийся вид злокачественного новообразования почки; на его долю приходится 90–95% от всех опухолей почек и около 4% от числа всех эпителиальных новообразований [1–3]. В течение последних двух десятилетий ежегодный прирост частоты ПКР составил 2% как в Европе, так и во всем мире (данные Всемирной организации здравоохранения за 2013 г.) [2, 4].
 Общемировая заболеваемость ПКР в 2012 г. составила около 338 тыс. случаев, при этом смертность превысила отметку в 144 тыс. [1]. В России, по данным Российского центра информационных технологий и эпидемиологических исследований в области онкологии за 2015 г., ПКР был выявлен у 22 846 человек, что составило 3,9% от всех впервые выявленных опухолей различных локализаций, при этом смертность составила 8511 случаев. В течение 1 года число зарегистрированных в России новых случаев ПКР выросло почти на 5% [5]. Рост числа впервые выявленных новообразований во многом обусловлен улучшением диагностики за счет более широкого использования в клинической практике современных лучевых методов визуализации: УЗИ, МСКТ и МРТ. Благодаря этим методам стало возможным раннее выявление небольших опухолей (стадия T1) [3], как правило, протекающих бессимптомно (более чем у половины заболевших) [6, 7].
Общемировая заболеваемость ПКР в 2012 г. составила около 338 тыс. случаев, при этом смертность превысила отметку в 144 тыс. [1]. В России, по данным Российского центра информационных технологий и эпидемиологических исследований в области онкологии за 2015 г., ПКР был выявлен у 22 846 человек, что составило 3,9% от всех впервые выявленных опухолей различных локализаций, при этом смертность составила 8511 случаев. В течение 1 года число зарегистрированных в России новых случаев ПКР выросло почти на 5% [5]. Рост числа впервые выявленных новообразований во многом обусловлен улучшением диагностики за счет более широкого использования в клинической практике современных лучевых методов визуализации: УЗИ, МСКТ и МРТ. Благодаря этим методам стало возможным раннее выявление небольших опухолей (стадия T1) [3], как правило, протекающих бессимптомно (более чем у половины заболевших) [6, 7].
За последние годы возросла доля органосохраняющих пособий, которые стали применяться не только по абсолютным показаниям (опухоль единственной почки, двусторонние опухоли), а все чаще – по относительным и избирательным показаниям. Во всем мире наблюдается тенденция к снижению травматичности операций [4]. На сегодняшний день в ведущих урологических центрах мира не более 5% всех проводимых вмешательств открытые [8]. На фоне стремления к снижению инвазивности большую популярность набирает такая альтернатива хирургическому лечению, как криоаблация.
Впервые криоаблация рака почки была выполнена еще в 1974 г. в эксперименте на животных [9]. Однако ввиду технических трудностей (громоздкая конструкция криомашины, толстые криозонды и отсутствие контроля за проведением процедуры) метод не сумел обрести популярность. Технический прогресс и появление новых лучевых методов исследования в 1980-х гг. возродили интерес к криохирургии [10]. И уже в 1993 г. G. Onik и соавт. [11] опубликовали данные о контроле за процессом формирования ледяного шара при помощи ультразвука. А в 1994 г. английским ученым F. Lee были разработаны и применены температурные сенсоры, при помощи которых обеспечивалось точное достижение требуемой температуры [12]. Уже в 1995 г. в Японии доктором M. Uchida была выполнена чрескожная криоаблация опухоли почки человека [13]. Разрушение тканей во время криоаблации служит результатом двух последовательных этапов: этап заморозки – во внеклеточном пространстве формируются кристаллы льда, что ведет к росту осмотического давления; последн...












