Кардиология №6 / 2015
Действие апелина-12 и его аналога на гемодинамику и сократительную функцию сердца крыс с изопротереноловым поражением миокарда
1Научно-исследовательский институт экспериментальной кардиологии ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва; 2Институт клинической кардиологии им. А.Л. Мясникова ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Введение изопротеренола крысам — одна из распространенных экспериментальных моделей сердечной недостаточности. Она обусловлена диффузным ишемическим повреждением кардиомиоцитов с последующим развитием заместительного фиброза. Апелин является одним из естественных регуляторов сократимости миокарда. В данной работе изучали действие фрагмента молекулы апелина — апелина-12 и его более устойчивого синтетического аналога апелина-12-2 на сократительную функцию сердца крыс с изопротереноловым поражением миокарда (ИПМ) и контрольных животных при помощи инвазивных (катетеризация левого желудочка — ЛЖ) и неинвазивных (эхокардиография и импедансометрия) методов. Инфузию обоих пептидов осуществляли, последовательно увеличивая скорость введения с 0,5 до 50 мкг/кг/мин. В контрольной группе апелин-12 был малоэффективен, в то время как апелин-12-2 умеренно, но достоверно повышал показатели сократимости и расслабимости миокарда. У крыс с ИПМ эти изменения были выражены сильнее и, кроме того, у них отмечали повышение частоты сердечных сокращений и систолического давления в ЛЖ. Эти результаты хорошо коррелируют с данными эхокардиографии, показавшими увеличение конечного диастолического объема, ударного объема и фракции выброса ЛЖ на 17—38%. Последние изменения, вероятно, обусловлены улучшением транспорта Са2+ в кардиомиоцитах, так как в опытах на изолированных кардиомиоцитах оба апелина ускоряли и углубляли удаление Са2+ из миоплазмы, но апелин-12-2 действовал сильнее. Результаты позволяют сделать вывод, что апелин-12-2 представляется перспективным в качестве кандидата для дальнейшей разработки как терапевтического средства при сердечной недостаточности.
Терапия сердечной недостаточности остается одной из наиболее сложных проблем кардиологии. В последние годы укрепляется тенденция использования в качестве терапевтических средств естественных молекул — регуляторов и модуляторов функции. Одним из наиболее мощных естественных регуляторов сократимости миокарда является апелин [1—3]. Естественный апелин состоит из 77 аминокислотных остатков, но в организме он подвергается дальнейшему протеолизу до более коротких фрагментов, сохраняющих его биологическую активность, — апелин-36, 19, 17, 13 и 12. Фрагмент молекулы апелин-12 (H-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe-OH), отличающийся от апелина-13 отсутствием глутамина в N-конце, наименее изучен. На изолированных кардиомиоцитах данный пептид увеличивал силу сокращений и уровень Са2+ в систоле [2], а также улучшал восстановление функции миокарда после ишемии и реперфузии, сопровождавшейся активацией NO-синтазы и антиоксидантных ферментов [4, 5]. Однако высокая активность пептидаз в крови снижает эффективность использования этого пептида в эксперименте и клинике [6]. Кроме того, в состав апелина-12 входит метионин, который чрезвычайно легко окисляется кислородом воздуха до соответствующего сульфоксида, что ухудшает стабильность вещества при хранении [7].
В лаборатории синтеза пептидов РКНПК был синтезирован ряд аналогов апелина-12. Предварительные испытания [8], проведенные на изолированных кардиомиоцитах, показали, что наиболее эффективным по воздействию на внутриклеточный транспорт Са2+ является аналог II, в котором метионин, легко окисляемый кислородом, был заменен норлейцином — аминокислотой небелкового происхождения, устойчивой к окислению, а остаток аргинина в положении 1 заменен остатком Nα-метиларгинина (H-(Nα-Me)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-OH). Этот аналог также отличался от других меньшим влиянием на артериальное давление [8]. В данной работе было изучено действие этого аналога, а также апелина-12 на сократительную функцию миокарда крыс с хроническим ишемическим поражением, вызванным синтетическим катехоламином, — изопротеренолом. Предварительные результаты работы представлены ранее [9].
Материал и методы
Опыты выполняли на наркотизированных кетамином (100 мг/кг) самцах крыс Вистар массой 400—450 г. Одна группа крыс получала изопротеренол в дозировках 150—180 мг/кг дважды с суточным интервалом, смертность в этих сериях колебалась от 32 до 40%. Контрольная группа получала изотонический раствор натрия хлорида. Выжившие животные и контрольные были исследованы с применением различных неинвазивных и инвазивных методов.
Эхокардиография. Исследование функции сердца наркотизированных крыс выполняли на аппарате iE33 («Philips Ultrasound», «Bothell WA», США) с использованием датчика S12-4 (12—4 MГц). Конечный диастолический и конечный систолический размеры левого желудочка (ЛЖ), а также толщину задней стенки ЛЖ измеряли в М-режиме из пара-стернального доступа в проекции длинной оси сердца; площадь поперечного сечения ЛЖ в конце диастолы (Sd, см2) и в конце систолы (Ss, см2) определяли из парастернального доступа в проекции по короткой оси сердца на уровне папиллярных мышц, рассчитывая процент изменения площади поперечного сечения ЛЖ в систолу по следующей формуле: ΔS%= (Sd – Ss)/Sd · 100. Объемы ЛЖ (конечный диастолический объем — КДО, конечный систолический объем — КСО) и фракцию выброса (ФВ) определяли с использованием модифицированного алгоритма Симпсона из апикального доступа в 3 проекциях (4- и 2-камерных и по длинной оси ЛЖ). Интеграл линейной скорости кровотока (VTI, см) — эквивалент ударного объема, а также ударный объем ЛЖ (УО, мл) и минутный объем (МО, мл/мин) определяли с помощью допплеровского исследования в импульсном режиме на уровне выходного тракта ЛЖ.
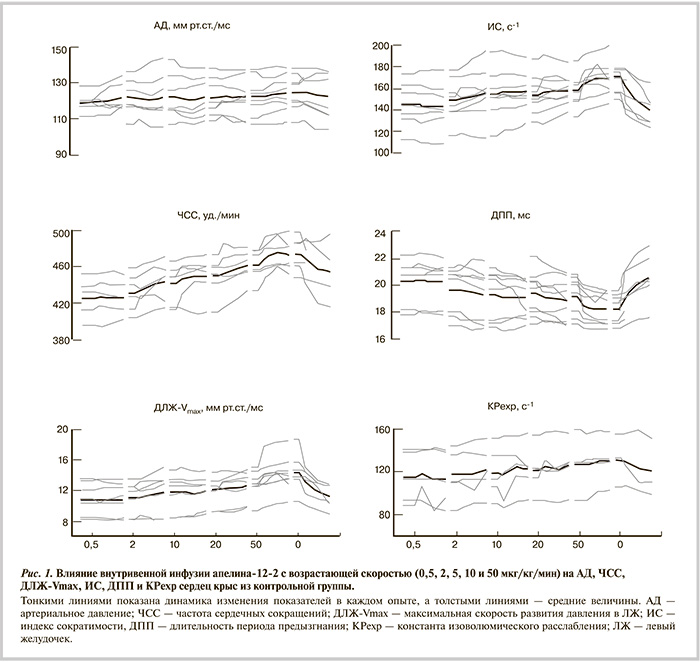
Инвазивное исследование. У животных непрерывно регистрировали электрокардиограмму (ЭКГ) во II стандартном отведении, среднее артериальное давление (АД), давление в ЛЖ и тетраполярную импедансную кардиограмму (ТИКГ). В яремную вену вставляли катетер для введения веществ. Действие исходного пептида, а также его аналога изучали при последовательной инфузии с нарастающей скоростью от 0,5 до 50 мкг/мин/кг, каждую дозу вводили в течение 8 мин.
Для регистрации давления в ЛЖ и аорте использовали милларовский прецизионный микроманометр на конце тонкого (диаметр 0,53 мм) катетера («SciSense Instruments», Канада), введенный через сонную артерию, и тензометрический усилитель Hugo Sachs Elektronik (США). АД через катетер в бедренной артерии измеряли с помощью электроманометра Gould Statham P23 Db (CША). Для регистрации ТИКГ вводили подкожно электроды-иглы в области нижней челюсти и одной из нижних конечностей, а сигнальные — по верхней и нижней границе грудины. Сигнал ТИКГ (ΔZ) регистрировали с помощью модифицированного для работы с мелкими лабораторными животными реоплетизмографа РПКА-2-01 («Медасс», Россия) с расширенной полосой пропускания (от 0,1 до 150 Гц при несущей частоте 40 кГц и ам...












