Акушерство и Гинекология №3 / 2015
Диагностика вульвовагинального кандидоза: сопоставление информативности клинических данных и результатов лабораторных исследований
1ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва 2ФГБУ Поликлиника № 1 Управления делами Президента Российской Федерации, Москва
Цель исследования. Сравнение диагностических характеристик лабораторных методов и клинических признаков в диагностике вульвовагинального кандидоза (ВВК).
Материал и методы. В исследование были включены 154 пациентки, обратившиеся к гинекологу с жалобами на выделения из половых путей, зуд, жжение, гиперемию в области половых органов. Обследование включало проведение микроскопии, культурального исследования и полимеразной цепной реакции (ПЦР) с количественным определением пяти наиболее значимых видов Candida.
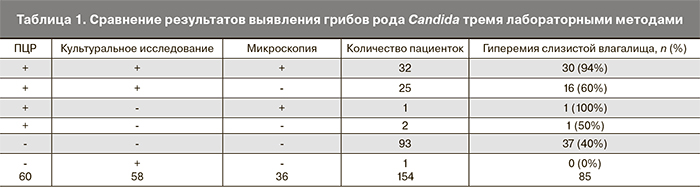
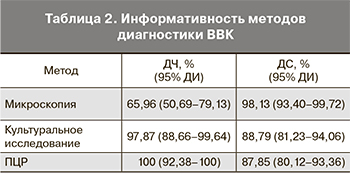
Результаты. ВВК был установлен у 47 (30,5%) пациенток. Диагностическая чувствительность и специфичность микроскопии составила 66 и 98% соответственно, культурального исследования –
98 и 89% соответственно, ПЦР – 100 и 88% соответственно.
Заключение. Метод ПЦР и культуральное исследование продемонстрировали такие преимущества, как высокая чувствительность и специфичность, возможность количественного определения содержания Candida spp. и их видовой идентификации. Сроки получения результата методом ПЦР были сопоставимы с таковыми для микроскопического исследования.
Вульвовагинальный кандидоз (ВВК) – это вторая по частоте выявления причина патологических вагинальных выделений у женщин репродуктивного периода [1]. Примерно у 56–75% женщин развивается как минимум один эпизод ВВК в течение жизни, у 50% из них развивается повторный эпизод, а 8% женщин страдают от рецидивирующего ВВК [2].
Диагностика ВВК основывается на оценке жалоб и клинической картины, а также результатов лабораторных исследований. Клинические признаки ВВК включают зуд, жжение, отечность слизистых оболочек, творожистые выделения, гиперемию слизистой вульвы и/или влагалища. Однако ни один из них не является патогномоничным. Так, например, «классические» творожистые выделения выявляются только у 20–60% пациенток, а зуд у 50–87% [3].
Основными методами лабораторной диагностики ВВК являются микроскопия окрашенного препарата и культуральное исследование – посев на среду Сабуро.
Микроскопия окрашенного препарата позволяет получить результаты исследования в короткие сроки, однако чувствительность данного метода составляет 40–60% [4]. Кроме того, микроскопия не позволяет отличить C. albicans от других видов кандид, хотя известно, что C. glabrata и C. krusei проявляют резистентность или дозозависимую чувствительность к препаратам азолового ряда [5].
Культуральное исследование обладает большей чувствительностью [4], однако длительное время проведения исследования (до 7 дней) ограничивает использование метода, когда при наличии острого процесса необходимо быстрое получение результата.
В последние годы в лабораторную практику активно внедряются молекулярно-биологические методы (в частности, полимеразная цепная реакция (ПЦР) в режиме реального времени), которые, с одной стороны, обладают высокой чувствительностью, а с другой – позволяют получить результаты исследования в кратчайшие сроки [6–8]. Ранее в ФБУН ЦНИИ Эпидемиологии был разработан набор реагентов «АмплиСенс-Флороценоз/Кандиды-FL», который позволяет проводить определение и количественную оценку наиболее значимых видов Candida (С. albicans, C. glabrata, C. krusei, C. parapsilosis, C. tropicalis) в биоматериале из влагалища.
Целью данного исследования стало сравнение диагностических характеристик лабораторных методов (микроскопия, культуральное исследование, ПЦР) и клинических признаков в диагностике ВВК.
Материал и методы исследования
В исследование были включены образцы биологического материала от 154 пациенток Научно-консультативного клинико-диагностического центра (НККДЦ) ФБУН ЦНИИ Эпидемиологии Роспотребнадзора. Сбор материала проводили с декабря 2012 по июнь 2013 года. Средний возраст пациенток составил 28±6,3 года (от 17 до 45 лет). Основным критерием включения пациенток в исследование было наличие одного или нескольких симптомов инфекций вульвы/влагалища: жалобы на выделения из половых путей, зуд, жжение, гиперемию в области половых органов. В исследование включали пациенток, не принимавших антимикробные и пробиотические препараты, а также не использовавших антисептические средства в течение 4 недель до посещения врача. Все пациентки подписывали форму информированного согласия на участие в исследовании. Исследование было одобрено этическим комитетом ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Всем пациенткам проводили осмотр влагалища и шейки матки в зеркалах, а также бимануальное исследование. При осмотре получали вагинальные мазки с боковой стенки влагалища ватным тампоном (3 образца от каждой пациентки). Один из образцов помещали в пробирку со средой Amies, второй – в пробирку с транспортной средой ТСМ (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), третий наносили на стекло для дальнейшей окраски по Граму и проведения микроскопии. Полученные образцы хранили следующим образом: образец для проведения культурального исследования – при температуре 6±2°C не более 24 часов до момента доставки в лабораторию, образцы для проведения ПЦР и микроскопии – при комнатной температуре не более двух суток до момента исследования.
 Для проведения микроскопии образцы окрашивали по Граму, далее проводили исследование с применением объективов х10 и х100. Во всех образцах регистрировали соотношение полиморфноядерных лейкоцитов (ПМЯЛ) и эпителиальных клеток (ЭК) как маркера воспалительной реакции слизистой влагалища, состав и соотношение разных морфотипов, наличие дрожжеподобных грибов.
Для проведения микроскопии образцы окрашивали по Граму, далее проводили исследование с применением объективов х10 и х100. Во всех образцах регистрировали соотношение полиморфноядерных лейкоцитов (ПМЯЛ) и эпителиальных клеток (ЭК) как маркера воспалительной реакции слизистой влагалища, состав и соотношение разных морфотипов, наличие дрожжеподобных грибов.
Культуральное исследование включало посев материала, выделение чистой культуры, идентификацию выделенного гриба рода Candida. Посев производили на чашки Петри со средой Сабуро с левомицетином методом истощающего штриха. Чашки помещали в термос...












