Фарматека №14 (267) / 2013
Дисбиоценоз кишечника, пародонтит и метаболически ассоциированные сердечно-сосудистые заболевания
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова», Москва Автор для связи: А.М. Шилов – д.м.н., проф., зав. кафедрой неотложных состояний в клинике внутренних болезней ФППОВ; e-mail: Alexmshilov@mail.ru
Представлены результаты исследования с участием 69 пациентов, из которых 54 были с клиническими и лабораторными признаками метаболического синдрома (МС), целью которого была оценка влияния эндобиоза пищеварительного тракта на липидно-углеводный обмен. По данным исследования, у пациентов с абдоминальным типом ожирения (индекс массы тела ≥ 25 кг/м2) в подавляющем большинстве (от 80 до 90 % случаев) случаев имеет место нарушение микробиоза кишечника – дисбиоз, сопровождаемое развитием системного воспаления, активацией свободнорадикальных процессов (оксидативный стресс), снижением регионального и общего иммунитета. Включение в комплексную программу лечения на ранних этапах развития МС симбиотиков (корректоров микрофлоры ЖКТ), антиоксидантов (коэнзима-Q10) способствует восстановлению микрофлоры пищеварительного тракта, общего и регионального иммунного статуса, улучшению репаративных процессов пародонта, купированию оксидативных процессов, восстановлению чувствительности инсулиновых рецепторов, нормализации липидно-углеводного спектра крови.
Современные рекомендации по диагностике и лечению сердечно-сосудистых заболеваний (ССЗ) большое значение придают выявлению и коррекции факторов риска (ФР) развития патологий сердечно-сосудистой системы. Эти ФР во многом универсальны, т. е. характерны для большинства ССЗ и хорошо известны.
В настоящее время ФР подразделяют на:
- «модифицируемые» – частота сердечных сокращений, ожирение, уровень холестерина, уровень артериального давления (АД), нарушение толерантности к углеводам (НТГ) или сахарный диабет 2 типа (СД2), курение;
- «немодифицируемые» – возраст, пол, расовая принадлежность, отягощенный семейный анамнез;
- «мягкие» – агрегационное состояние крови, низкий уровень липопротеидов низкой плотности (ЛПНП) и α-липопротеина, высокий уровень С-реактивного белка – СРБ, гомоцистеина, мочевой кислоты, тканевого активатора плазминогена-1, фактора некроза опухоли α (ФНО-α), интерлейкинов (ИЛ) 1–8 и т. д.
Каждый ФР имеет свой удельный вес в вероятности развития того или иного заболевания сердечно-сосудистой системы. При этом совместное воздействие нескольких ФР на одного пациента способствует существенному увеличению риска развития сердечно-сосудистых осложнений: c 5,5 % – у пациентов с 1 ФР до 21,8 % – с 8 и более ФР.
В 1991 г. V. Dzau и E. Braunwald сформулировали понятие «единый сердечно-сосудистый континуум», которое в течение последних 20 лет конца ХХ – начала ХХI вв. прочно вошло в научно-медицинскую практику. Применительно к практической медицине «континуум» (от английского «continuous» – постоянный, непрерывный) подразумевает непрерывную последовательность этапов развития заболевания – от ФР до летального исхода [1].
Метаболический синдром (МС) в контексте «сердечно-сосудистого континуума» – комплекс метаболических нарушений, ССЗ, патогенетически взаимосвязанных через инсулинорезистентность (ИР). Метаболические нарушения включают НТГ или СД2 с характерной атерогенной дислипидемией (повышение уровней триглицеридов – ТГ, ЛПНП, снижение уровня липопротеидов высокой плотности – ЛПВП), которые сопровождаются развитием артериальной гипертензии (АГ), ишемической болезни сердца (ИБС; рис. 1).
За последние 20 лет основные компоненты МС – нарушения углеводного и липидного спектров крови – рассматриваются клиницистами как доминирующие ФР ССЗ.
Зарубежные и отечественные исследователи в клинической медицине, эксперты Всемирной организации здравоохранения характеризуют МС, основной клинический признак которого – абдоминальное ожирение с ИР и атерогенной дислипидемией, как «пандемию ХХI в.». В 2012 г. Международная федерация диабета представила эпидемиологические данные распространенности СД как составную часть МС: в 47 странах Европейского региона (в т. ч. в России), в которых проводились исследования, зарегистрированы 52,8 млн пациентов в возрасте от 20 до 79 лет, страдавших СД, что составляет 8,1 % от населения. Согласно прогнозам, этот показатель к 2030 г. увеличится до 9,5 %, что составит 64 млн человек [1, 3, 8].
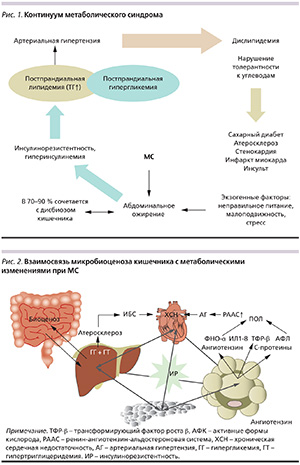 Клинические исследования последних 20 лет (конец ХХ – начало ХХI вв.), основанные на современных научных достижениях теоретической и практической медицины, продемонстрировали четкую взаимосвязь нарушений углеводного (предиабет – НТГ или СД) и липидного (атерогенез) спектров крови (компоненты МС) с функциональным состоянием печени (развитие неалкогольной жировой болезни печени – НЖБП) и статусом микробиоценоза кишечника (дисбиозом) [1–3, 5, 8, 13, 17].
Клинические исследования последних 20 лет (конец ХХ – начало ХХI вв.), основанные на современных научных достижениях теоретической и практической медицины, продемонстрировали четкую взаимосвязь нарушений углеводного (предиабет – НТГ или СД) и липидного (атерогенез) спектров крови (компоненты МС) с функциональным состоянием печени (развитие неалкогольной жировой болезни печени – НЖБП) и статусом микробиоценоза кишечника (дисбиозом) [1–3, 5, 8, 13, 17].
Нормальная микрофлора пищеварительного тракта (полость рта и кишечник) у человека имеет чрезвычайно большое общебиологическое значение: помимо осуществления трофики она ответственна за формирование до 80 % общего иммунного и регионального статусов. Наиболее важными и изученными функциями микрофлоры кишечника являются обеспечение антиинфекционной защиты, формирование и стимуляция иммунной системы макроорганизма, обеспечение всасывания минералов, воды, синтез витаминов группы В и К, регуляция липидного и углеводного обменов, регуляция моторики кишечника. Все это определяет микрофлору кишечника как самостоятельный орган. Выявлено, что абдоминальный тип ожирения с индексом массы тела (ИМТ) > 25 кг/м2 в 70–90 % случаев сочетается с дисбиозом кишечника и в такой же пропорции – со стеатозом или стеатогепатитом как следствие нарушения липидного обмена [2–5, 10, 18, 19].
В связи с этим возникают определенные трудности при назначении гиполипидемических препаратов, в частности статинов, которые, обладая известными гепатотоксическими побочными эффектами, могут усугублять функциональное состояние печени при наличии доклинических форм НЖБП на фоне дисбиоза – вплоть до развития лекарственного гепатита. В случаях нераспознанного стеатоза или стеатогепатита побочные эффекты лекарственных препаратов могут быть следствием нарушения их метаболизма в печени (патология ферментной цитохромной системы печени Р450).
Кишечный микр...












