Урология №6 / 2014
Доброкачественные образования предстательной железы, имитирующие аденокарциному
Кафедра урологии (зав. каф. – д.м.н., проф. Д.Ю. Пушкарь) МГМСУ им. А.И. Евдокимова, Москва
Рак предстательной железы стоит на 2-м месте по распространенности и на 6-м – по смертности среди всех онкологических заболеваний у мужчин. Нельзя отрицать социальную значимость рака предстательной железы, однако обращает на себя внимание ощутимый перевес вновь выявленных случаев над уровнем раково-специфической смертности. «Золотым» стандартом диагностики служит морфологическое исследование фрагментов ткани предстательной железы после трансректальной мультифокальной биопсии. Важность дифференциального диагноза особенно актуальна при анализе фрагментов ткани простаты, полученных в результате биопсии, т.к. ложноположительный результат может обусловливать проведение ненужного и чрезмерного лечения. В данной статье представлены наиболее распространенные доброкачественные процессы, которые могут симулировать аденокарциному различных степеней злокачественности. Знание о наличии подобных канцеромимикрий, а также внимательное изучение микропрепаратов в большинстве случаев позволяют прийти к верному заключению.
Согласно данным мировой статистики, в 2008 г. было зарегистрировано 899 тыс. новых случаев рака предстательной железы (РПЖ), а также 258 тыс. случаев смерти от этого заболевания. Это ставит рак простаты на 2-е место по распространенности и на 6-е – по смертности среди всех онкологических заболеваний у мужчин [1]. Нельзя отрицать социальную значимость РПЖ, однако обращает на себя внимание ощутимый перевес числа вновь выявленных случаев РПЖ над уровнем раково-специфической смертности. Так, по данным американского онкологического общества, в 2013 г. в США это соотношение для РПЖ составило 8:1, тогда как для рака легкого и рака толстой кишки оно составило 1,4:1,0 и 2:1 соответственно [2].
Высокая выявляемость РПЖ во многом объясняется внедрением в клиническую практику в начале 1990-х гг. теста на простатспецифический антиген (ПСА). Безусловно, ПСА показал себя как один из наиболее эффективных скрининг-маркеров РПЖ. Однако в настоящее время целесообразность скрининга РПЖ на основании уровня ПСА служит предметом многочисленных дискуссий. Рак предстательной железы относится к заболеваниям с длительным латентным периодом. Кроме того, широкое использование анализа на ПСА привело к существенному росту частоты выявления высокодифференцированных опухолей, расположенных в пределах простаты. С учетом этих обстоятельств возникает вопрос о влиянии ПСА-скрининга на смертность от РПЖ. Опубликованные данные наиболее крупных исследований в рассматриваемой области PLCO и ERSPC показали неоднозначные результаты [3]. Согласно Кокрановскому обзору, в который вошло 5 рандомизированных контролируемых исследований, скрининг не влияет на раково-специфическую выживаемость [4].
Подобные работы не подразумевают отказ от программы ПСА-скрининга РПЖ. Речь идет об оптимизации стратегии раннего выявления данного заболевания. Тем не менее смысл совершенно ясен – следует по возможности свести к минимуму случаи гипердиагностики. Эта проблема также усугубляется тем, что существует ряд доброкачественных состояний, имитирующих аденокарциному простаты. В свете растущего числа выполняемых биопсий простаты как следствия ПСА-скрининга проблема канцеромимикрии приобретает все большую актуальность. Среди различных морфологических типов РПЖ абсолютно подавляющее большинство принадлежит аденокарциноме, поэтому в дальнейшем речь будет идти о дифференциальной диагностике именно с данным типом злокачественных новообразований.
К главным диагностическим критериям для постановки диагноза «аденокарцинома простаты» относятся нарушение клеточной архитектоники, отсутствие слоя базальных клеток, наличие видимых ядрышек, а также изменения тинкториальных свойств клеток ацинусов. Существует также ряд дополнительных критериев, свидетельствующих об аденокарциноме простаты, – фигуры митоза, наличие эозинофильных включений, кристаллоидов, базофильного муцина в просвете желез и ряд других.
Для оценки степени дифференцировки аденокарциномы простаты используется шкала Глисона, в основе которой лежит оценка тканевой атипии с использованием малого и среднего увеличения.
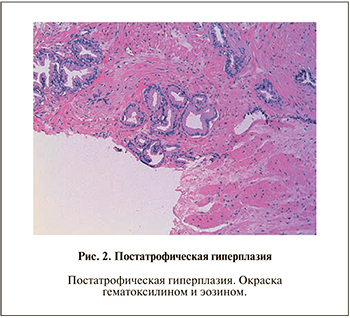 Наиболее часто дифференциальную диагностику с мелкоацинарной аденокарциномой приходится проводить в случае атрофии (полной или частичной), постатрофической гиперплазии, аденоза, а также при наличии в исследуемом материале ткани семенных пузырьков.
Наиболее часто дифференциальную диагностику с мелкоацинарной аденокарциномой приходится проводить в случае атрофии (полной или частичной), постатрофической гиперплазии, аденоза, а также при наличии в исследуемом материале ткани семенных пузырьков.
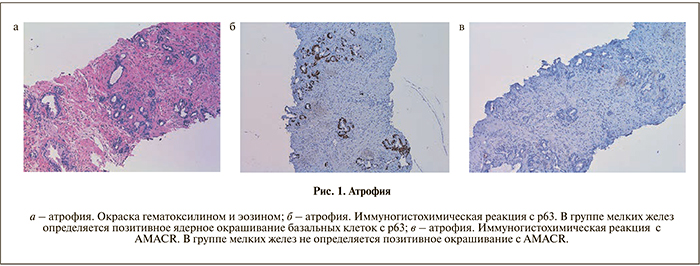
Атрофия
Атрофия простатических желез – довольно распространенный процесс у пожилых мужчин, однако может также встречаться среди пациентов более молодого возраста. Атрофия часто ассоциирована с хроническим воспалением в простате. Кроме того, атрофия может быть результатом лучевой и антиандрогенной терапии. Данное явление чаще всего наблюдается в периферической зоне простаты.
Различают четыре формы атрофии: дольковую (простую), склеротическую, кистозную и линейную [5]. Зачастую отмечается сочетание этих форм. В случае простой атрофии мелкие железы объединены в округлой формы гнезда. При склеротической атрофии между мелкими железами расположены в большом количестве волокна стромы, в результате чего ацинусы имеют угловатую, неправильную форму. Для кистозной атрофии характерна дилатация ацинусов. При этом рядом, как правило, располагаются более характерные для атрофии железы. Наконец при линейной атрофии мелкие, темные ацинусы располагаются в линию, создавая впечатление проникновения в строму.
Несмотря на различия в клеточной архитектуре, отличительные черты самих клеток схо...












