Фарматека №4 / 2024
Доксорубицин и токсичность
Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова, Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербург, Россия
Доксорубицин относится к антракциклинам: ингибиторам топоизомеразы. Будучи препаратом широкого противоопухолевого действия, антрациклины применяются при многих злокачественных опухолях (лейкозы, лимфомы, рак молочной железы, рак эндометрия, шейки матки, нейробластома, опухоль Вильмса и др.). К наиболее значимым поздним токсическим проявлениям относится кардиотоксичность. Действием свободных радикалов объясняется кардиотоксический эффект, присущий данному классу препаратов. Отмечено, что в дни, следующие за введением химиопрепарата, повышалось содержание тропонина-I в плазме крови и у пациентов с такими явлениями возрастала степень риска поздних осложнений со стороны сердечно-сосудистой системы. Целью данного обзора служило описание механизма действия доксорубицина, побочных действий, выявление предикторных маркеров кардиотоксичности, а также способов по преодолению токсичности и повышению эффективности. Возможность синтеза новых материалов открыла новое перспективное направление в области биотехнологии, в частности получение наночастиц карбоната кальция в водных растворах. Система доставки препарата позволяет снижать его общетоксический эффект и пролонгировать терапевтический эффект. Дальнейшее исследование процесса высвобождения препарата представляется актуальной задачей на данный момент. Отмечается значительное увеличение риска кардиотоксичности при дозах свыше 550 мг/м2. Как правило, онкологи рекомендуют применение суммарных доз доксорубицина, не превышающих 300 мг/м2, в отношении как детей, так и взрослых.
Введение: доксорубицин как фенольный антиоксидант
Фенолы, попадающие в наш организм с пищей, проявляют свои ингибирующие свойства в радикальных биохимических процессах. Данная способность фенолов чрезвычайно важна. Известно, многие формы онкологических заболеваний инициируются активными свободными радикалами. Образуя устойчивые, а потому малореакционноспособные радикалы, многоатомные фенолы обрывают цепи в радикальных реакциях и тем самым тормозят развитие радикальных реакций, в т.ч. тех, которые сопровождают рост злокачественных опухолей. Доксорубицин относится к группе антрациклиновых антибиотиков, обладает широким спектром фармакологического действия и является эффективным средством против рака [1] (см. рисунок).
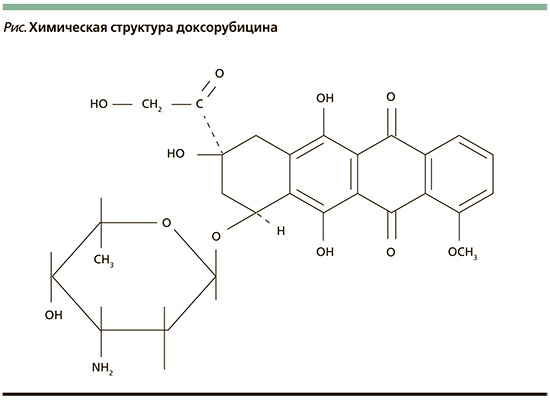
В методах противоопухолевой терапии применяются подходы, основанные на индуцировании гибели клеток путем повышения внутриклеточной концентрации активных форм кислорода (АФК) – высокореакционных продуктов метаболизма кислорода [2]. Механизм повышения продукции АФК доксорубицином – генерация АФК митохондриальными оксидоредуктазами [2–6].
Механизм развития кардиотоксичности доксорубицина и предикторные биомаркеры
Данный препарат относится к классу ингибиторов топоизомеразы или к препаратам, интеркалирующим цепь ДНК (производное бульонных грибов S. peucetius). Топоизомераза-II (Topo-II) связывается с ДНК и вызывает разрыв двойной спирали, что обусловливает раскручивание нитей нуклеиновой кислоты. Образуя ковалентную связь с комплексом ДНК–Topo-II, доксорубицин мешает восстановлению разорванной нити.
Антрациклиновая кардиотоксичность обусловлена образованием АФК – реактивных оксигенных образований, вследствие обмена электронами между хиноновой частью антрациклина и молекулами кислорода, а также другими донаторами электронов, имеющимися в клетках [7]. В системе окислительно-восстановительной активации доксорубицина могут принимать участие некоторые флавопротеиновые редуктазы, NO-синтетаза, цитохром Р-450 редуктаза, НАДФИ-дегидрогеназы [8]. Для двух последних ферментов необходимо присутствие ионов Fe2+, образовавшиеся комплексы подвергаются окислительно-восстановительным реакциям, в результате которых образуются кислородные радикалы [7, 8].
Таким образом, противопухолевый эффект сопряжен с неблагоприятными эффектами на сердечно-сосудистую систему и развитием ишемии миокарда, эндомиокардиального фиброза, антрациклиновой кардиомиопатии, сердечной недостаточности и различных видов аритмий [9]. Экспериментальные данные показали, что к основным электрокардиографическим изменениям на моделях животных при введении доксорубицина относятся удлинение интервала QT [9–13], расширение комплекса QRS (что свидетельствует о нарушениях внутрижелудочковой проводимости) [9, 10, 13], отрицательное хронотропное действие, приводящее в конечном итоге к аритмиям [9, 14, 15].
Кардиотоксичность, обусловленная антрациклинами, подразделяется на острую (кратковременное снижение сократительной способности миокарда непосредственно после введения препарата, частота <1%), раннюю хроническую (диагностированную в течение первого года после лечения, частота – 1,6–2,1%), позднюю хроническую, проявляющуюся в виде дилатационной кардиомиопатии в период от 1-го года после окончания лечения и до 10–30 лет после первого введения препарата.
Методы диагностики СН
Помимо функциональных методов диагностики (ЭКГ, ЭХО-КГ, радиоизотопная вентрикулография [MUGA scan]), уступающих по чувствительности в диагностике сердечной недостаточности (СН) [16, 17], существуют еще и лабораторные (кардиоспецифические белки).












