Урология №6 / 2015
Экспериментальное обоснование создания гибридной матрицы и тканеинженерной конструкции на основе сетки из полилактогликолида и реконструированного коллагена с целью последующей заместительной уретропластики
Первый МГМУ им. И. М. Сеченова; кафедра урологии лечебного факультета; НИИ молекулярной медицины; НИИ уронефрологии и репродуктивного здоровья человека
Стриктуры мочеиспускательного канала – актуальная медицинская проблема. Одним из наиболее эффективных способов их лечения остается заместительная уретропластика. Несмотря на хорошие результаты, которые демонстрирует данный вид оперативного пособия, по-прежнему не решен ряд вопросов: дефицит материала для субституции при протяженных и рецидивных стриктурах, а также при двух- и многоэтапных операциях, в том числе в случае гипоспадии; а также морбидность в донорской зоне. Кроме того, процедура забора лоскута или трансплантата увеличивает длительность оперативного пособия, что сопряжено с повышением риска интра- и послеоперационных осложнений. Помочь в преодолении указанных выше проблем может тканевая инженерия, которая подразумевает использование тканеинженерных конструкций, состоящих из матрицы и клеток. В рамках настоящей работы проведена оценка свойств созданной нами гибридной матрицы на основе реконструированного коллагена и сетки из полилактогликолида. Показано, что использование сетки из полилактогликолида и реконструированного коллагена позволяет создавать стабильную и функциональную композитную конструкцию; полученная гибридная матрица не проявляет цитотоксических свойств, клетки активно прикрепляются к ее поверхности, а затем пролиферируют; в процессе биодеградации матрица замещается структурно и функционально полноценными новообразованными тканями уротелия, а также слизистой оболочки мочеиспускательного канала. Лишь у одного из 12 кроликов отмечено формирование стриктуры уретры в месте имплантации матрицы. Все вышесказанное позволяет рассматривать созданную нами гибридную матрицу как потенциальный материал для тканеинженерной конструкции
с последующим применением при заместительной уретропластике у человека.
Введение. Патологические сужения просвета мочеиспускательного канала, или стриктуры, вызванные фиброзными изменениями субэпителиальных структур спонгиозного тела или окружающих тканей [1, 2], приводят к нарушению оттока мочи, вызывая развитие ряда вторичных изменений урогенитального тракта [3]. Распространенность стриктур уретры зависит от возраста и, по разным оценкам, варьируется от 0,01 до 0,9% мужского населения [1, 4]. Заболеваемость стриктурами уретры в развитых странах может достигать 9 случаев на 1000 лиц мужского пола [4], что обусловливает более 5000 госпитализаций в год [5]. По данным мета-анализа [6], ведущей причиной (33%) развития стриктур передней уретры является ятрогенное повреждение во время медицинских процедур (катетеризация, эндоскопические пособия и т.д.). Второй по распространенности (19%) причиной служит повреждение уретры вследствие травмы (ДТП, падение на промежность и т.д.); третьей (15%) – инфекции (например, гонорейный уретрит).
Оптическая уретротомия и бужирование являются малоинвазивными методами лечения. Вместе с тем выполнение данных процедур оправданно только при коротких первичных стриктурах, преимущественно луковичного отдела уретры. Эффективность оптической уретротомии в таких случаях может достигать 66–90% в краткосрочной перспективе, однако в отдаленном периоде отмечается существенное ухудшение результатов вмешательства, что свидетельствует о нерадикальности метода [7–9].
С учетом вышесказанного предпочтение отдается различным видам уретропластик, как анастомотическим, так и заместительным (с использованием трансплантатов или лоскутов). В последнее время наиболее широко используемым материалом для заместительной уретропластики является слизистая оболочка щеки [10, 11], которая обладает рядом преимуществ по сравнению с другими трансплантатами и лоскутами. Буккальная уретропластика применяется при стриктурах любой протяженности, множественных стриктурах, в том числе при рецидивных стриктурах. При относительной простоте хирургической техники данный метод позволяет добиваться надежных и хороших результатов подавляющему большинству пациентов [12–15]. Послеоперационные осложнения могут проявляться в двух областях: в донорской зоне и в месте реконструкции уретры [16]. Гнойные воспаления в области послеоперационной раны промежности, гематомы, нарушение кожной чувствительности регистрируются крайне редко [17–19]. Потенциальными осложнениями в месте забора трансплантата могут быть кровотечение, боль, отек тканей лица, повреждение протока околоушной слюной железы (Stensen), парестезии, а также ограничение подвижности в височно-нижнечелюстном суставе. Отеки лица и ограничения подвижности в височно-нижнечелюстном суставе самостоятельно проходят в течение первых 3 мес и встречаются довольно редко [10, 20–22].
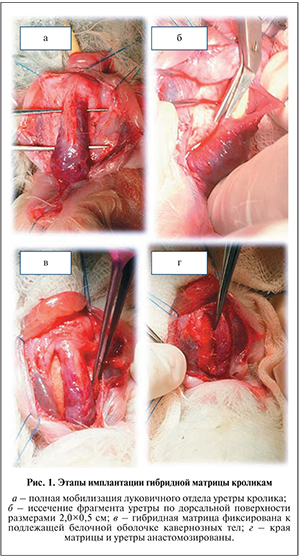 Несмотря на указанные достоинства слизистой оболочки щеки, остается нерешенным ряд вопросов. Во-первых, необходимость получения любого трансплантата в той или иной степени сопряжена с морбидностью в донорской зоне. Даже если эта морбидность низкая или крайне низкая, она всё же присутствует и оказывает отрицательное влияние на состояние пациента. Выраженность данного влияния напрямую зависит от размеров донорской зоны. Во-вторых, протяженные стриктуры уретры требуют забора графтов (трансплантатов) из нескольких донорских участков. Это существенно увеличивает время хирургического вмешательства, а следовательно, и риск интра- и послеоперационных осложнений [23]. В-третьих, при повторных заместительных уретропластиках (в случаях рецидивов стриктуры) забор слизистой оболочки ротовой полости может быть затруднен, что диктует необходимость поиска дополнительного материала для субституции. Аналогичная ситуация возникает во время первого этапа двухэтапных уретропластик, когда требуется эпителизация уретрального ложа. Указанные выше проблемы свидетельствуют об отсутствии в настоящее время идеального материала для заместительной уретропластики, что обосновывает целесообразность его (материала) поиска.
Несмотря на указанные достоинства слизистой оболочки щеки, остается нерешенным ряд вопросов. Во-первых, необходимость получения любого трансплантата в той или иной степени сопряжена с морбидностью в донорской зоне. Даже если эта морбидность низкая или крайне низкая, она всё же присутствует и оказывает отрицательное влияние на состояние пациента. Выраженность данного влияния напрямую зависит от размеров донорской зоны. Во-вторых, протяженные стриктуры уретры требуют забора графтов (трансплантатов) из нескольких донорских участков. Это существенно увеличивает время хирургического вмешательства, а следовательно, и риск интра- и послеоперационных осложнений [23]. В-третьих, при повторных заместительных уретропластиках (в случаях рецидивов стриктуры) забор слизистой оболочки ротовой полости может быть затруднен, что диктует необходимость поиска дополнительного материала для субституции. Аналогичная ситуация возникает во время первого этапа двухэтапных уретропластик, когда требуется эпителизация уретрального ложа. Указанные выше проблемы свидетельствуют об отсутствии в настоящее время идеального материала для заместительной уретропластики, что обосновывает целесообразность его (материала) поиска.
Тканевая инженерия открыла новые перспективы для реконструктивной хирургии, одной из областей применения которой является уретропластика.
В регенеративной урологии используются как матрицы без клеток [24–34], так и матрицы (матриксы, скаффолды) с различными видами аутологичных клеток [35–38], или тканеинженерные конструкции. Разработка оптимальной тканеинженерной конструкции (матрица+клетки, получаемые неинвазивным путем [39, 40]) позволит свести к нулю морбидность в донорской зоне, решит проблему нехватки материала для заместительной уретропластики (даже при протяженных и/или рецидивных стриктурах уретры), а также сократит длительность операции, что обеспечит снижение риска интра- и послеоперационных осложнений.
Одним из критериев успешной реализации тканеинженерной уретропластики считается наличие матрицы, обладающей оптимальными биомеха...












