Кардиология №2 / 2017
Электрофизиологические свойства клеток миокардиальных рукавов легочных вен крыс
Институт экспериментальной кардиологии ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
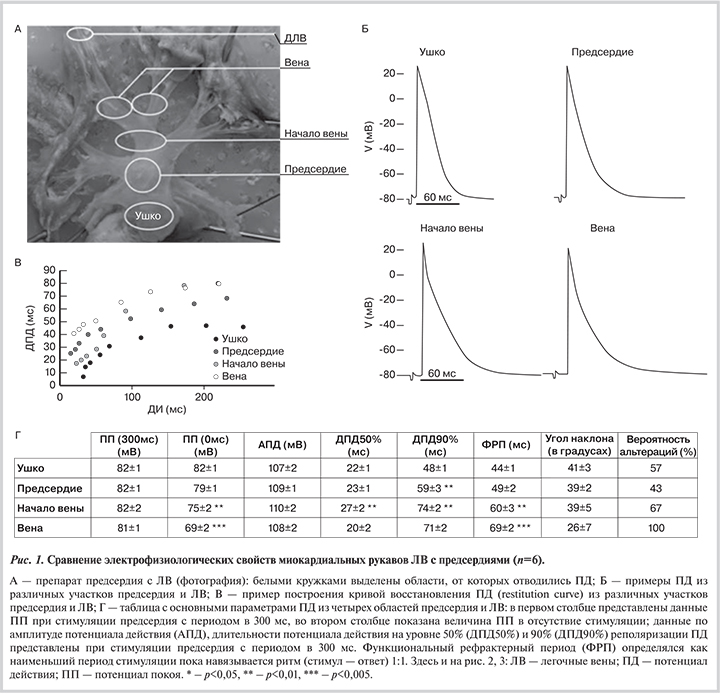
Мерцание и трепетание предсердий чаще всего возникают в устье легочных вен (ЛВ). Ткань данной области отличается от предсердной, обладая целым рядом морфологических и электрофизиологических особенностей. В данной работе использовали стандартную микроэлектродную технику, при этом использовали двухэлектродные отведения для регистрации электрофизиологических характеристик потенциала действия (ПД). Показано, что длительность ПД достоверно растет (48±1, 59±3, 74±2 и 71±2 мс в ушке, предсердии, устье ЛВ и ЛВ соответственно). При этом потенциал покоя (ПП) в ушке и предсердии стабилен, в то время как ПП в ЛВ деполяризуется без стимуляции, а в дистальной части ПП деполяризован даже при наличии стимуляции предсердий, если на него дополнительно не воздействовать нейромедиаторами. Миокард ЛВ — крайне неоднородная среда с сильной дисперсией длительности ПД и изменяющейся скоростью проведения, что может способствовать возникновению ФП.
Еще в 1876 г. Т. Brunton и J. Frayer наблюдали продолжительную «независимую пульсацию» в легочных венах (ЛВ) кроликов и кошек после остановки предсердного ритма [1]. В 1910 г. G. Favaro показал наличие миокардиальных рукавов в ЛВ [2]. Впоследствии структурная [3] и электрическая [4] связь между предсердием и рукавами ЛВ была обнаружена у человека. В 1998 г. М. Haissaguerre и соавт. опубликовали статью, в которой убедительно показали, что в большинстве случаев причиной возникновения фибрилляции предсердий (ФП) у человека является возникновение эктопической активности в устьях ЛВ [5]. Эти данные вызвали новую волну исследований этой области.
Недавно показано, что потенциал покоя (ПП) в устьях ЛВ не-стабилен и в отсутствие ритма может деполяризовываться примерно на 10 мВ [6]. Кроме того, воздействие на α-адренорецепторы приводит к дополнительной деполяризации ПП до –50 мВ, в то время как стимуляция β-адренорецепторов — к восстановлению ПП. При одновременной стимуляции α- и β-адренорецепторов норадреналином в дозе 10–5 М в большинстве случаев наблюдалась спонтанная активность [6, 7].
Однако большинство экспериментальных электрофизиологических исследований ограничиваются непосредственно устьями ЛВ, не исследуя дистальную часть ЛВ. В то же время в клинических исследованиях показано, что у пациентов, страдающих ФП, средняя длина миокардиальных рукавов больше, чем у людей, не подверженных ФП [8]. У человека при клинической диагностике источник эктопической активности чаще обнаруживался в дистальной части миокардиальных рукавов ЛВ, на расстоянии около 2—4 см от устья ЛВ [5, 9].
В данной работе сравнивали электрофизиологические свойства в различных местах предсердий и миокардиальных рукавов ЛВ, прежде всего, исследовали дистальную часть ЛВ и выявляли отличия предсердных клеток от кардиомиоцитов (КМЦ) рукавов ЛВ.
Материал и методы
Опыты проводили на крысах линии Вистар массой 350—400 г. Животных наркотизировали раствором уретана (2 г/кг внутрибрюшинно), содержащим гепарин (0,2 ед.), после чего вскрывали грудную клетку, быстро извлекали сердце вместе с легкими и помещали в емкость с раствором Тироде комнатной температуры следующего состава (в моль/л): NaCl — 118; KCl — 4,7; CaCl2 — 1,8; MgCl2 — 1,2; NaHCO3 — 25, NaH2PO4 — 1,2; глюкоза — 11. Легкие отделяли, область левого предсердия и ЛВ освобождали от фасций, жировой ткани, после чего отпрепаровывали левое предсердие вместе с ушком и участками ЛВ, исключая межпредсердную перегородку. Препарат помещали в перфузионную камеру объемом 2,5 мл. После фиксации препарата за ушко температуру раствора Тироде постепенно повышали до 37 ºС. Перфузионный раствор оксигенировали газовой смесью (95% O2 и 5% CO2), pH 7,35±0,05. Участок ЛВ, прилегающий к левому предсердию, разрезали и разворачивали в перфузионной камере таким образом, чтобы внешняя сторона препарата была обращена ко дну камеры, а эндокардиальная сторона — к экспериментатору. В экспериментах в камере ушко, предсердие и центральную вену выделяли как цельный препарат, отрезая остальные ЛВ и ответвления от центральной ЛВ. Отметим, что центральную ЛВ выделяли до развилки в конце легкого, где она разветвляется. После окончательного отделения ЛВ от фасций и фиксации ЛВ препарат начинали стимулировать в области ушка с периодом стимуляции S1—S1=300 мс. Перфузию осуществляли со скоростью 18 мл/мин раствором Тироде при температуре 37 оС.
Измерения электрофизиологических параметров. Измерения проводили не ранее чем через 30 мин после нагревания раствора Тироде до 37 ºС. Потенциал действия (ПД) регистрировали при помощи стеклянных микроэлектродов, заполненных 3М раствором KCl (сопротивление электродов от 10 до 40 МОм). Сигналы усиливали при помощи усилителя KS-701 (W-P Instruments). Все сигналы записывали в цифровой форме (частота оцифровки 5 кГц) на компьютер с помощью АЦП (Е-154, L-Card). Для записи и обработки сигналов использовали программу L-Graph. ПД отводили от эндокардиальной поверхности препарата.
Протокол №1 (частотный протокол). После адаптации препарата проводили измерения при несущей частоте в течение 1 мин. Потом увеличивали частоту стимуляции и снова записывали ПД в течение 1 мин. Частоту стимуляции увеличивали до тех пор, пока навязывался ритм (стимул — ответ) 1:1. После завершения частотной стимуляции в течение 15 мин проводилось восстановление препарата с периодом стимуляции 300 мс. По истечении последнего срока повторяли измерения в следующем отделе препарата.












