Фарматека №16 (210) / 2010
Этиопатогенетическая роль инсулинорезистентности в развитии метаболических и сосудистых нарушений при сахарном диабете типа 2
Рассматриваются патогенетические механизмы развития сахарного диабета типа 2 (СД2) с упором на роль инсулинорезистентности (ИР). ИР и компенсаторная гиперинсулинемия играют ключевую роль в патогенезе нарушений углеводного обмена, что подтверждают данные многочисленных клинических и экспериментальных работ, однако они имеют многогранный потенциал для развития каскада других метаболических и сосудистых нарушений. В частности, активно изучается взаимосвязь ИР и гиперинсулинемии с нарушениями липидного обмена. Обсуждаются современные подходы к лечению СД2 с использованием метформина, инкретиномиметиков и тиозолидиндионов. Единственным представителем последних на лекарственном рынке на сегодняшний день остается пиоглитазон.
Сахарный диабет (СД) 2 типа во всем мире признан одной из наиболее важных медико-социальных проблем современного здравоохранения вследствие постоянно растущей заболеваемости, высокой инвалидизации и смертности в работоспособном возрасте.
СД 2 типа относится к состояниям хронической гипергликемии, обусловленной прогрессирующей потерей чувствительности тканей к действию инсулина и относительной инсулиновой недостаточностью, ассоциированной с развитием макро- и микрососудистых осложнений. Клинически наиболее важна инсулинорезистентность (ИР) мышечной, жировой и печеночной тканей, которая приводит к многочисленным структуральным, гормональным и метаболическим последствиям. Поскольку 75 % глюкозы утилизируется скелетной мускулатурой, естественно, наиболее важным проявлением ИР может быть нарушение стимулированного инсулином захвата глюкозы скелетными мышцами. ИР мышечной ткани является наиболее ранним, возможно генетически определяемым, дефектом, проявляющимся снижением транспорта глюкозы и глюконеогенеза в миоцитах, намного опережающим клиническую манифестацию СД 2 типа.
На уровне жировой ткани ИР проявляется снижением антилиполитического действия инсулина. Это приводит к неконтролируемому окислению липидов и высвобождению большого количества свободных жирных кислот (СЖК), повышение уровня которых ведет к ингибированию процессов транспорта и фосфорилирования глюкозы и как следствие – к ослаблению окисления глюкозы, а также синтеза гликогена в мышцах. Избыток СЖК активизирует процессы глюконеогенеза, влияет на синтез липопротеидов в печени, приводя к повышенному образованию липопротеидов очень низкой плотности (ЛПОНП) и триглицеридов (ТГ), что сопровождается снижением уровня липопротеидов высокой плотности (ЛПВП). Кроме того, постоянное повышение уровня СЖК в плазме способствует аккумуляции липидов в островковых клетках поджелудочной железы, оказывая липотоксичный эффект на β-клетки, нарушающий их функцию.
ИР гепатоцитов характеризуется снижением синтеза гликогена и активацией процессов гликогенолиза, а также повышением продукции глюкозы de novo из аминокислот, лактата, пирувата, глицерина (глюконеогенез), в результате чего ее поступление в кровоток повышается.
Компенсаторным ответом на ИР независимо от ее причины является увеличение секреции инсулина в β-клетках поджелудочной железы и его избыточное выделение в кровь. В результате относительной или абсолютной гиперинсулинемии уровень глюкозы крови поддерживается в пределах нормального диапазона. Впоследствии длительная ИР, избыточные алиментарные потоки углеводов и жиров, хронически повышенная секреторная активность β-клеток, “липотоксичность” приводят к постепенному истощению секреторной способности β-клеток, клинической манифестации углеводных нарушений и дебюту СД. Гипергликемия замыкает “порочный круг”, вызывая снижение чувствительности β-клеток к действию глюкозы и других стимулов, что усиливает выраженность секреторного дефекта β-клеток (“глюкозотоксичность”). Сформулированная выше концепция развития СД 2 типа (см. рисунок) основана на наличии двух фундаментальных патофизиологических дефектов: ИР и дисфункции β-клеток поджелудочной железы, причем оба феномена существуют, взаимообусловливая и отягощая друг друга, и присутствуют в течение многих лет до манифестации заболевания.
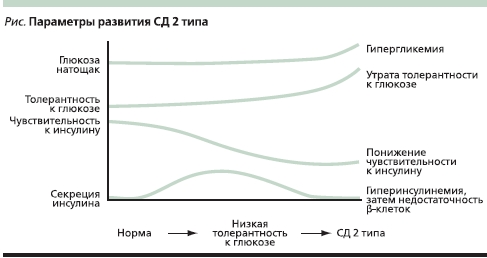
Изучение ИР показало, что это чрезвычайно вариабельный параметр. При его определении с помощью прямого кламп-метода опосредованная инсулином утилизация глюкозы, даже у лиц с нормальной толерантностью к ней, может колебаться в значительных пределах, приближаясь в 25 % случаев к характерной для СД 2 типа. Первоначально нормогликемия у таких пациентов поддерживается за счет компенсаторной гиперсекреции инсулина, а гипергликемия развивается лишь при истощении β-клеток поджелудочной железы. При развитии СД 2 типа имеющаяся ИР прогрессирует. При определении ее степени с помощью того же кламп-метода выявляются достоверные различия в снижении скорости утилизации глюкозы у лиц с нормальной толерантностью к глюкозе и больных СД 2 типа. Причем отмечается обратная зависимость скорости утилизации глюкозы от уровня гликемии натощак: чем выше концентрация глюкозы крови, тем меньше скорость ее поглощения тканями.
В настоящее время ИР продолжают рассматривать как важнейшее патофизиологическое нарушение, присущее СД 2 типа, предшествующее декомпенсации функциональной активности островковых клеток поджелудочной железы и, возможно, ответственное за формирование сердечно-сосудистых нарушений, а также онкологическую предрасположенность. Собственно ИР – это нарушение биологического ответа клеток инсулинчувствительных тканей на воздействие эндогенного или экзогенного инсулина при достаточной его концентрации в крови. Свое биологическое действие на уровне клетки инсулин осуществляет посредством связ...












