Акушерство и Гинекология №5 / 2015
Факторы риска развития дисморфизмов ооцитов в программах вспомогательных репродуктивных технологий
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Качество ооцитов играет существенную роль в получении полноценных эмбрионов, а, следовательно, в эффективности лечения бесплодия с помощью вспомогательных репродуктивных технологий (ВРТ).
Цель исследования. Оценка клинико-анамнестических и ятрогенных факторов риска развития различных дисморфизмов ооцитов у пациенток программ ВРТ.
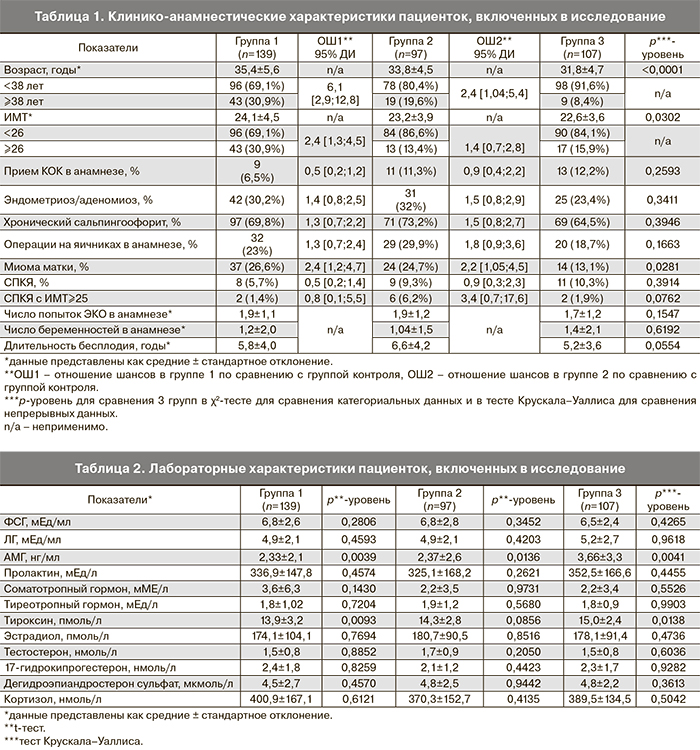
Материал и методы. В проспективное исследование случай-контроль были включены 343 женщины, проходящих лечение в программах ВРТ. В зависимости от наличия или отсутствия дисморфизмов ооцитов пациентки были разделены на 3 группы: группа 1 – женщины с цитоплазматическими дисморфизмами ооцитов, группа 2 – женщины с экстрацитоплазматическими дисморфизмами ооцитов, группа 3 (контроль) – пациентки с морфологически нормальными ооцитами. Оценка клинико-анамнестических, лабораторных характеристик, а также особенностей выбранного протокола стимуляции осуществлялась с помощью логистической регрессии с построением ROC-кривых.
Результаты. На развитие цитоплазматических дисморфизмов ооцитов в однофакторном анализе значимое влияние оказывали возраст пациентки, индекс массы тела (ИМТ), уровень антимюллерова гормона (АМГ) и свободного тироксина (Т4), в многофакторном анализе – возраст женщин и уровень Т4. На развитие экстрацитоплазматических дисморфизмов ооцитов в однофакторном анализе значимое влияние оказывали возраст пациенток, уровень АМГ и применение агонистов гонадотропин-рилизинг гормона (а-ГнРГ) в качестве триггера овуляции или в протоколах стимуляции, в многофакторном анализе – уровень АМГ и применение а-ГнРГ.
Заключение. Качество ооцитов определяется различными факторами, большинство из которых (возраст пациентки, овариальный резерв, наличие генетических нарушений) являются не модифицируемыми. Пациенткам с риском получения морфологически аномальных ооцитов требуется комплексный подход в коррекции метаболических нарушений и соматических заболеваний, а также дифференцированный подход в выборе подходящего протокола стимуляции овуляции.
Известно, что исход программ экстракорпорального оплодотворения (ЭКО) определяется наличием полноценного эмбриона для переноса в полость матки. Качество ооцитов играет существенную роль в развитии эмбрионов. В клинической практике ЭКО качество ооцитов оценивается преимущественно по их морфологическим характеристикам до и после оплодотворения. При этом аномалии строения ооцитов (дисморфизмы) подразделяются на две группы: цитоплазматические и экстрацитоплазматические. К цитоплазматическим аномалиям относятся повышение гранулярности цитоплазмы, вакуолизация, скопление аномальных агрегатов гладкого эндоплазматического ретикулума (ГЭР), а также наличие разнообразных цитоплазматических включений. Ооциты с цитоплазматическими дисморфизмами имеют более низкую частоту оплодотворения, а эмбрионы, полученные из таких клеток, обладают низким потенциалом к имплантации и дальнейшему развитию [1–3]. К экстрацитоплазматическим аномалиям относятся изменение ширины перивителлинового пространства, наличие гранулярности в перивителлиновом пространстве, изменение формы или толщины зоны пеллюцида, а также аномалии строения первого полярного тельца. Отрицательное влияние данных дисморфизмов на частоту оплодотворения клетки и развитие эмбриона спорно [1, 4].
Известно, что значительная часть ооцитов, полученных в циклах стимуляции суперовуляции, имеют те или иные аномалии строения. При этом возможными факторами риска их появления могут быть как клинические характеристики пациенток, так и различные ятрогенные факторы. В качестве возможных предикторов появления дисморфизмов ооцитов рассматривают возраст женщины, овариальный резерв яичников, генетические особенности, а также наличие метаболических нарушений (избыточная масса тела и ожирение) и гинекологических заболеваний (наружный генитальный эндометриоз, синдром поликистозных яичников, хроническая ановуляция) [5–7]. Особое внимание уделяется влиянию различных протоколов стимуляции функции яичников в программах ЭКО, длительности стимуляции функции яичников и суммарной дозы вводимых гонадотропинов на качество ооцитов [8–10]. Однако единого мнения о влиянии перечисленных факторов на появление дисморфизмов ооцитов не существует.
В связи с этим целью настоящего исследования стала оценка клинико-анамнестических и ятрогенных факторов риска развития различных дисморфизмов ооцитов у пациенток программ ЭКО.
Материал и методы исследование
В проспективное исследование случай-контроль, которое проводилось в период с сентября 2013 г. по сентябрь 2014 г., были включены 343 женщины с бесплодием различного генеза, нормальным кариотипом, отсутствием противопоказаний к проведению ЭКО и подписанным информированным согласием на участие в исследовании. Все женщины были разделены на три группы: группа 1 (n=139) – женщины с цитоплазматическими дисморфизмами ооцитов, группа 2 (n=97) – женщины с экстрацитоплазматическими дисморфизмами ооцитов, группа 3 (контроль, n=107) – пациентки с морфологически нормальными ооцитами. Критерием отнесения пациенток в группу с дисморфизмами было наличие 100% ооцитов с патологией цитоплазмы или экстрацитоплазматическими нарушениями, в группу без дисморфизмов – наличие 100% нормальных ооцитов. Группы формировались методом подбора пар по числу полученных ооцитов (2–5 ооцитов, 6–10 ооцитов и более 10 ооцитов) и эмбриологу, выполнявшему морфометрию клеток (морфологическое исследование ооцитов осуществлялось 3 эмбриологами). Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению» [11].
Стимуляция функции яичников проводилась с применением рекомбинантного ФСГ или комбинированного препарата рекомбинантного ФСГ и ЛГ, и назначением как агонистов (а-ГнРГ), так и антагонистов гонадотропин-рилизинг-гормона (ант-ГнРГ). Распределение различных протоколов стимуляции овуляции было следующим: протокол с ант-ГнРГ был назначен 285 пациенткам (83,1%), модифицированный протокол с ант-ГнРГ – 23 пациенткам (6,7%), длинный протокол с а-ГнРГ – 13 пациенткам (3,8%), короткий протокол с а-ГнРГ – 7 пациенткам (2%). ЭКО в естественном цикле было произведено 15 пациенткам (4,4%). Триггер овуляции вводили при наличии в яичниках фолликулов диаметром 17 мм и более. В качестве триггера использовали человеческий хорионический гонадотропин (ЧХГ) в дозе 7500–10000 МЕ, а-ГнРГ (декапептил) в дозе 0,2 мг, или сочетание а-ГнРГ с ЧХГ в дозе 1500 МЕ. Всего препараты ЧХГ были назначены 295 пациенткам, препараты а-ГнРГ – 34 пациенткам, а их сочетание – 14 пациенткам. Трансвагинальная пункция яичников осуществлялась через 36 ч после введения триггера.
Очищение ооцитов от клеток кумулюса осуществляли как энзимным, так и механическим путем; зрелые клетки на стадии МІІ культивировали отдельно от незрелых. Морфологич...












