Фарматека №16 (269) / 2013
Фармакотерапия диабетической невропатии: что еще кроме контроля гликемии?
Кафедра эндокринологии и диабетологии МГМСУ им. А.И. Евдокимова, Москва
Представлены современные знания о природе диабетической невропатии (ДН) и ее наиболее частой форме – дистальной невропатии. Тяжелые проявления ДН наблюдаются примерно у 10 % больных сахарным диабетом. Обосновывается широкое применение в лечении дистальной ДН комплексных препаратов витаминов группы В – Мильгаммы и Мильгаммы композитум (содержит жирорастворимое производное тиамина – бенфотиамин). Применение препаратов Мильгамма и Мильгамма композитум значительно повышает возможности фармакотерапии дистальной ДН, способствует улучшению качества и прогноза жизни больных.
Несмотря на достижения в области изучения сахарного диабета (СД), хронические осложнения этого заболевания остаются серьезной проблемой для многих пациентов. Поражение нервной системы при СД приводит к развитию диабетической невропатии (ДН), частота которой варьируется от 30 до 90 %, прогрессивно нарастая по мере увеличения длительности диабета [1, 2]. Это одно из наиболее тяжелых осложнений СД, поскольку характеризуется ранней инвалидизацией пациентов и значительным ухудшением качества их жизни в целом. Тяжелые проявления ДН наблюдаются примерно у 10 % больных СД [3, 4].
Наиболее распространенной и хорошо известной формой ДН является дистальная невропатия (ДДН). В половине случаев она протекает бессимптомно, но в связи с утратой болевой чувствительности пациенты подвергаются высокому риску повреждения ног [1, 2, 5]. Известно, что ДДН лежит в основе развития 75 % случаев синдрома диабетической стопы, угрожающими проявлениями которого являются язвенно-некротические поражения, а наиболее тяжелым последствием – ампутация конечности [3, 6]. Частота последних у больных СД в 15–30 раз превышает таковую в общей популяции и составляет 50–70 % общего числа всех нетравматических ампутаций [1, 4, 7]. Вторая по частоте форма ДН – автономная невропатия, наблюдаемая среди 15–30 % больных СД 2 типа при постановке диагноза и у половины спустя 20 лет от начала заболевания. При этом существенно повышается смертность, особенно в случае нарушения иннервации сердца (рис. 1).
Проявления автономной невропатии крайне разнообразны и включают сердечно-сосудистые, желудочно-кишечные, урогенитальные нарушения и др. [8–10].
Центральная роль в патогенезе ДН принадлежит хронической гипергликемии, которая приводит к повреждению нервов и нарушению эндотелиальной функции. Известно, что риск развития ДН повышается на 10–15 % на каждый 1 ммоль/л подъема концентрации гликемии натощак или на 1 % уровня гликированного гемоглобина (HbA1c) [11]. Принято считать, что выраженные колебания концентрации глюкозы в крови с достижением высоких пиковых значений имеет большее повреждающее действие, чем постоянный высокий уровень гликемии.
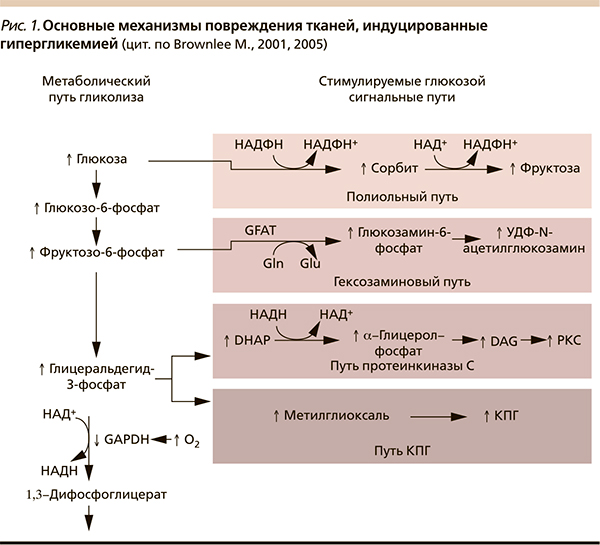
Напомним, что утилизация глюкозы в нервной системе происходит по концентрационному градиенту независимо от уровня инсулина. В связи с этим нервная ткань, как, впрочем, и другие инсулиннезависимые ткани, не способна ограничивать поступление глюкозы при повышении ее концентрации в крови. Нервная ткань крайне уязвима в условиях внутриклеточной гипергликемии, т. к. при избытке глюкозы активируются альтернативные метаболические пути ее метаболизма, что способствует дегенерации и демиелинизации нервных волокон (рис. 2) [1]. Избыток глюкозы неизбежно используется по полиоловому пути (путь ее утилизации в инсулиннезависимых тканях), превращаясь в сорбитол. При этом внутриклеточное накопление сорбитола приводит к увеличению осмолярности межклеточного пространства, отеку нервной ткани, снижению скорости проведения импульса по миелиновым волокнам. Кроме того, подавляется синтез важного компонента миелина – миоинозитола, снижается активность Na+/K+-АТФазы. Накопление фруктозо-6-фосфата стимулирует гексозаминовый путь; повышение уровня дигидроксиацетонфосфата (DGAP) приводит к продукции глицеральдегид-3-фосфата, глицерин-3-фосфата и других метаболитов, активирующих путь протеинкиназы С [1, 2, 6]. Эти триозофосфаты являются предшественниками метилглиоксаля – основного вещества, приводящего к образованию конечных продуктов гликирования (КПГ). Внутриклеточная продукция КПГ, изменяя транскрипцию генов, структуру белков внеклеточного матрикса и циркулирующих белков крови, приводит к нарушению функции клеток, воспалению и сосудистым повреждениям. Последствием активации протеинкиназы C становится активация ядерного фактора κb (NFκb), что приводит к снижению продукции оксида азота, повышению уровней эндотелина-1, трансформирующего фактора роста β и ингибитора активатора плазминогена-1, нарушению кровотока и возникновению окклюзии капилляров.
Несомненно, ведущая роль в развитии ДН принадлежит избыточному образованию активных форм кислорода в плазме крови, мембранах и цитоплазме клеток с последующим формированием оксидативого стресса. Известно, что патологические метаболические пути обмена глюкозы запускаются в ответ на повышенную продукцию супероксид-аниона в дыхательной цепи митохондрий (рис. 3) – процесс, вызванный хроническим избытком глюко...












