Акушерство и Гинекология №1 / 2015
Фотодинамическая терапия: новый подход в лечении вирус папилломы человека ассоциированной патологии шейки матки
ФГБУ МНИОИ им. П.А. Герцена Минздрава России, 125284 Россия, Москва, 2-й Боткинский проезд, д. 3
Цель исследования. Разработать методологические подходы к профилактике ВПЧ-ассоциированной предопухолевой и опухолевой патологии шейки матки.
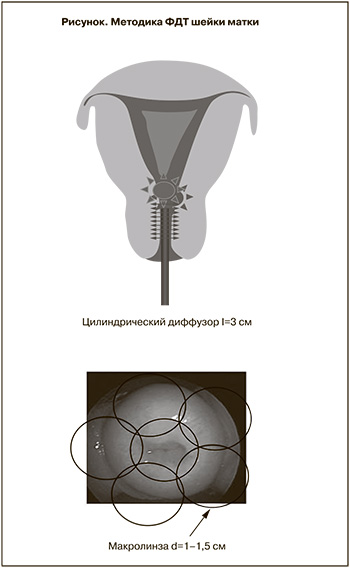
Материал и методы. В основу работы положены результаты лечения 195 женщин, инфицированных высокоонкогенными генотипами ВПЧ, у 25 из которых диагностирована дисплазия II степени, у 120 – дисплазия III степени и у 50 – рак in situ. При характеристике атипических изменений в цервикальном эпителии использованы принятые в отечественной литературе термины дисплазия II и III степени, рак in situ, которые в зарубежной литературе обозначены как CIN II–III, где в CIN III объединены дисплазия III степени и рак in situ. Сеанс лазерного облучения цервикального канала по всей его длине проводили с использованием гибкого кварцевого моноволоконного световода с цилиндрическим диффузором длиной 3 см, дающим матрицу света на 360%. Облучение влагалищной порции шейки матки осуществляли дистанционно с использованием световода с линзой диаметром 1–1,5 см, перпендикулярно подведенного к органу. Применена полипозиционная методика фотодинамического воздействия с диаметром светового пятна от 1 до 1,5 см, когда облучение начинается с области маточного зева одним полем с последовательным перемещением светового пятна вдоль всей поверхности шейки с перекрытием соседних полей на 0,3–0,4 см и захватом здоровых тканей на 0,3–0,5 см. Анализ непосредственных результатов фотодинамической терапии (ФДТ) в лечении ВПЧ-ассоциированной дисплазии II степени с препаратом фотосенс (0,3 мг/кг, время экспозиции 24 ч, доза световой энергии 100 Дж/см2) показал излечение во всех клинических наблюдениях независимо от локализации патологических изменений в цервикальном эпителии. В группе женщин с ВПЧ-ассоциированной дисплазией III степени, где ФДТ выполнена с препаратами фотогем (3,0 мг/кг, время экспозиции 72 ч, доза световой энергии 150 Дж/см2) и фотосенс (0,3 мг/кг, время экспозиции 24 ч, дозы световой энергии 150 Дж/см2), полная регрессия предрака достигнута в 92,5%. Отмечена высокая эффективность лечения при поражении экзоцервикса (96,8%) и несколько ниже – экзо-эндоцервикса (90%). В наблюдениях с раком in situ при проведении ФДТ с фотогемом (3,0 мг/кг) и фотосенсом (0,3 мг/кг) применены световые дозы 200 Дж/см2 и 150 Дж/см2. Полная регрессия достигнута у 80,7% женщин, при этом наиболее часто начальные опухолевые изменения были локализованы в экзоцервиксе (93,9%). Единичные случаи неэффективности лечения диагностированы преимущественно при локализации преинвазивного рака в эндоцервиксе.
Заключение. ФДТ с отечественными препаратами фотосенс и фотогем является «минимальным вариантом» органосохраняющего лечения ВПЧ-ассоциированной дисплазии II–III степени и начальной опухолевой патологии шейки матки, сопоставимым с традиционными лечебными воздействиями.
В России последние годы характеризуются ростом заболеваемости злокачественными новообразованиями шейки матки, частота которых за последнее десятилетие составила 3,1% [1]. При этом в старших возрастных группах наблюдается некоторая стабилизация уровня заболеваемости рака шейки матки (РШМ), тогда как число женщин c цервикальными неоплазиями в возрасте от 20 до 40 лет растет [2]. Неуклонный рост числа женщин со злокачественными новообразованиями шейки матки и тенденция к омоложению болезни, несомненно, свидетельствуют об актуальности поиска, разработки и внедрения новых подходов к профилактике и лечению РШМ. В успешной реализации этих задач важная роль отводится этиологическому фактору цервикального канцерогенеза – вирусу папилломы человека (ВПЧ), ДНК которого обнаруживается в 99,7% случаев РШМ [3].
Динамика вирусной инфекции может заключаться либо в ее регрессии, то есть элиминации вирусного пула, либо, наоборот, при длительной персистенции ВПЧ – прогрессии клеточных изменений в цервикальные интраэпителиальные неоплазии (CIN) I–II–III и микроинвазивный рак. Длительность этих процессов составляет от 2 до 10 лет [4], при этом вероятность их развития у женщин с персистирующей формой ВПЧ высокого онкологического риска по сравнению с не зараженной ВПЧ популяцией в среднем возрастает более чем в 300 раз [5]. Если сегодня не предпринимать профилактических и лечебных мер, то каждый случай плоскоклеточного рака через несколько лет будет ассоциирован с ВПЧ [6], а после 2050 г. ежегодно в мире РШМ будет заболевать 1 млн женщин [7].
В последние годы отмечается увеличение случаев стремительного развития РШМ в течение двух-трех лет после инфицирования ВПЧ у 15–28% женщин. При отсутствии же ВПЧ прогрессирование заболевания в короткие сроки развивается лишь у 1–3% женщин [8]. Неутешительный прогноз увеличения числа женщин с онкопатологией шейки матки в ближайшем будущем с большей убедительностью показывают первостепенное значение своевременного и эффективного лечения предопухолевых и начальных опухолевых поражений цервикального эпителия, что предотвратит развитие злокачественного процесса и прогрессирование заболевания до инвазивных форм.
Эти методы лечения согласно Я.В. Бохману (1989) можно условно разделить на два вида: деструктивные, то есть разрушающие патологическую ткань шейки матки (диатермокоагуляция, криодеструкция, лазерная вапоризация), и хирургические, удаляющие шейку матки в форме конуса (ножевая, лазерная, электро- и радиоволновая эксцизия). С появлением вирусной концепции цервикального канцерогенеза лечебные воздействия должны быть направлены и на геном ВПЧ. Такой подход к лечению ВПЧ-ассоциированной цервикальной патологии обусловлен недостаточной эффективностью монотерапии для элиминации ВПЧ, отсутствием «точечных» воздействий на геном вируса и неглубокой деструкцией [9].
Все эти причины ведут к сохранению ВПЧ в местах первичных поражений, зоне некроза, во внешне неизмененных тканях, прилежащих к краю резекции или деструкции [10]. Экспрессия персистирующей ДНК ВПЧ и реактивация вирусного генома обуславливают достаточно высокий риск развития в короткий срок после первичного лечения CIN I–II–III, прогрессирования процесса в преинвазивный или со временем – микроинвазивный рак (от 15 до 70%) [11].
 Таким образом, с учетом доказанной этиологической роли онкотропных типов ВПЧ в цервикальном канцерогенезе, увеличения числа заболевших женщин РШМ и омоложения болезни, участившихся случаев стремительного развития РШМ и рецидивов заболевания, назрела необходимость активного поиск...
Таким образом, с учетом доказанной этиологической роли онкотропных типов ВПЧ в цервикальном канцерогенезе, увеличения числа заболевших женщин РШМ и омоложения болезни, участившихся случаев стремительного развития РШМ и рецидивов заболевания, назрела необходимость активного поиск...












