Терапия №6 / 2016
Гидролизаты плаценты человека в реконструктивной терапии соединительной ткани хряща и суставов
1 ФГБОУ ВО «Ивановская государственная медицинская академия», г. Иваново;
2 ФГБОУ ВО «Московский физико-технический институт (государственный университет)», кафедра интеллектуальных систем,
г. Долгопрудный;
3 Медицинская корпорация RHANA, г. Москва
Одним из перспективных направлений клинического применения Лаеннека и других препаратов на основе гидролизатов плаценты человека (ГПЧ) является лечение ревматоидного артрита. Показано, что пептидные компоненты ГПЧ могут способствовать существенному ускорению восстановления соединительной ткани за счет противовоспалительного и трофического действия. Представлены результаты экспериментальных исследований препаратов на основе ГПЧ (в т.ч. препарата Лаеннек) для терапии моделей артрита. Рассмотрены перспективы клинических применений препаратов ГПЧ для лечения артрита.
Препараты на основе гидролизатов плаценты человека (ГПЧ) используются в современной клинической медицине, начиная с первой четверти XX в. Во многом клиническое использование ГПЧ стало возможным благодаря результатам, полученным известнейшим российским офтальмологом и хирургом В.П. Филатовым (1875–1956) [1]. С 1940-х гг. ГПЧ все более активно начинают исследовать и в других странах (Германия, Япония, Индия, Франция) [2]. К настоящему времени опубликовано более 4,5 тыс. статей, посвященных ГПЧ. Результаты проведенных исследований указали на широкий спектр возможных клинических применений ГПЧ: иммуномодуляция, заживление ран, нейротрофические эффекты, нормализация пигментации кожи, гепатопротекция и др.
Одним из перспективных направлений использования препаратов на основе ГПЧ представляется лечение ревматоидного артрита (РА) – хронического воспалительного заболевания, приводящего к прогрессирующей деструкции хрящевой ткани суставов и эрозии костной ткани. У пациентов с РА, особенно у женщин и больных с депрессией, все большее распространение получают методы комплементарной и альтернативной медицины, включающие в частности инъекции ГПЧ [3].
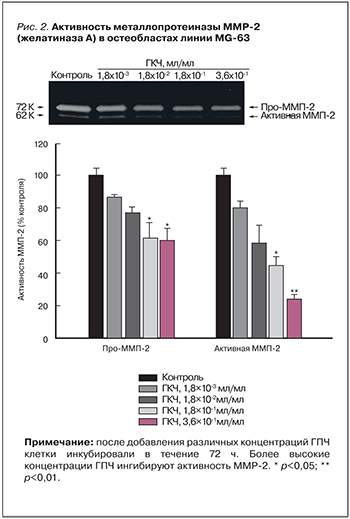
 Экспериментальные [4, 5] и клинические [6, 7] исследования, проведенные в 1950–1960-х гг., показали эффективность использования плацентарных препаратов при лечении артритов [8]. На моделях остеоартроза у кроликов, вызванного монойодацетатом, применение ГПЧ ингибировало деградацию протеогликана в суставном хряще, подавляло активность матричных коллагеназ 2 и 9, избыточная активность которых приводит к ускоренной деградации коллагеновых волокон соединительной ткани. Показано, что применение ГПЧ оказывало протекторный эффект на хрящевую ткань коленных суставов [9].
Экспериментальные [4, 5] и клинические [6, 7] исследования, проведенные в 1950–1960-х гг., показали эффективность использования плацентарных препаратов при лечении артритов [8]. На моделях остеоартроза у кроликов, вызванного монойодацетатом, применение ГПЧ ингибировало деградацию протеогликана в суставном хряще, подавляло активность матричных коллагеназ 2 и 9, избыточная активность которых приводит к ускоренной деградации коллагеновых волокон соединительной ткани. Показано, что применение ГПЧ оказывало протекторный эффект на хрящевую ткань коленных суставов [9].
Далее последовательно рассмотрены молекулярно-физиологические механизмы действия ГПЧ на регенерацию соединительной ткани, результаты экспериментальных исследований ГПЧ на моделях артрита (в т.ч. потенцирование препаратом Лаеннек регенеративных процессов хряща при адъювантном артрите) и перспективы клинического применения препаратов на основе ГПЧ для терапии артрита и других патологий костно-мышечной и костно-связочной систем.
МОЛЕКУЛЯРНО-ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ГПЧ НА РЕГЕНЕРАЦИЮ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Использование ГПЧ для ускорения процессов регенерации тканей основано на противовоспалительном, трофическом и антитромботическом эффектах ГПЧ. В эксперименте на модели резаной раны (выполнена биопсия эпителия длиной 8 мм) ГПЧ применялись топически и внутривенно (2,5 мл/кг). При обоих путях введения использование ГПЧ соответствовало значительному сокращению размера раны (р<0,05), индекса тяжести состояния раны (р<0,05), уменьшению среднего количества дней, необходимых для полного заживления (р<0,01), значительному приросту эластичности рубца и прочности на растяжение (р<0,01), заметному увеличению общего тканевого содержания ДНК и белков (в частности, коллагена) [10].
Важным компонентом регенеративного действия ГПЧ является противовоспалительный эффект. В эксперименте введение препарата стандартизированного ГПЧ Лаеннек внутривенно достоверно снижало уровни фактора некроза опухоли альфа (ФНО-α) и фермента синтеза простагландинов циклооксигеназы-2 (ЦОГ-2) при избыточно повышенных уровнях/активности этих белков. На моделях артрита отмечено снижение воспаления и повышение болевого порога [11].
Следует отметить, что ГПЧ также характеризуются выраженным противоболевым эффектом. В эксперименте ГПЧ значительно ингибировал выработку ФНО-α и ЦОГ-2, синтезирующей провоспалительные простагландины. В модели хронического артрита применение ГПЧ ослабляет отек, снижает образование гранулемы, увеличивает болевой порог в тесте Рэндалл–Селитто и продлевает время реакции крыс при нагреве поверхности кожи инфракрасными лучами [11].
Регенеративный, противовоспалительный и противоболевой эффекты ГПЧ обусловлены компонентами пептидного состава. К настоящему времени было предложено несколько различных молекулярных и физиологических механизмов, объясняющих ранозаживляющий эффект ГПЧ: увеличение уровней ростовых факторов фибробластов (ФРФ) [12], быстрая миграция нейтрофилов к ране [13], синтез NO, важнейшего клеточного медиатора в заживлении ран [14]. В частности, в составе препарата Лаеннек был найден противовоспалительный дипептид JBP485 (цикло-транс-4-гидроксипролилсерин), который снижает уровни секреции и ФНО-α и проявляет антиапоптотический эффект (снижение уровней и активности каспазы-3 – фермента-активатора апоптоза клеток [15]).
 В работе других исследователей [16] представлены результаты комплексного анализа пептидного состава препарата Лаеннек. В «легкой фракции» препарата (до 3000 Да) были найдены активный пептид нейромедина N и фрагмент активного пептида кокальцигенина. Было показано, что в состав Лаеннека входят пептидные ФРФ, фактора роста гепатоцитов (ФРГ, англ. HGF), инсулиноподобного фактора роста (ИФР, англ. IGF), эпидермальный фактор роста (ЭФР, англ. EGF), фактор роста нервов (ФРН, англ. NGF) и др. Эти ростовые факторы значительно ускоряют процессы регенерации поврежденных тканей и в то же время не оказывают существенного воздействия на здоровые ткани.
В работе других исследователей [16] представлены результаты комплексного анализа пептидного состава препарата Лаеннек. В «легкой фракции» препарата (до 3000 Да) были найдены активный пептид нейромедина N и фрагмент активного пептида кокальцигенина. Было показано, что в состав Лаеннека входят пептидные ФРФ, фактора роста гепатоцитов (ФРГ, англ. HGF), инсулиноподобного фактора роста (ИФР, англ. IGF), эпидермальный фактор роста (ЭФР, англ. EGF), фактор роста нервов (ФРН, англ. NGF) и др. Эти ростовые факторы значительно ускоряют процессы регенерации поврежденных тканей и в то же время не оказывают существенного воздействия на здоровые ткани.
Для регенерации соединительной ткани наиболее важна активность ФРФ, которые индуцируют клеточное деление фибробластов, хондроцитов, остеоцитов и других видов клеток соединительной ткани. Белки ФРФ связываются рецепторами ФРФ (FGFR) 4 различных типов. Связы...
0,05),>











