Трудный диагноз в педиатрии №6 / 2018
Глава 2. Клиническое наблюдение белок-теряющей энтеропатии после операции Фонтена у ребенка с единственным желудочком сердца
Врожденные пороки сердца (ВПС) — актуальная проблема педиатрии и кардиохирургии. По разным данным, показатели распространенности ВПС у детей значительно варьируют и составляют от 4 до 50 случаев на 1000 живорожденных [1, 2]. Одним из ВПС является единственный желудочек сердца (ЕЖС). ЕЖС — врожденный порок сердца цианотического типа, характеризующийся наличием трех камер сердца — двух предсердий и сообщающегося с ними через два атриовентрикулярных клапана единственного желудочка сердца, из которого через аортальный клапан и клапан легочной артерии отходят два магистральных сосуда [3]. При данном пороке кровообращение в малом и большом кругах осуществляется параллельно, а не последовательно, как в норме. Частота ЕЖС среди всех ВПС по клиническим данным составляет 1—3,2%, по патологоанатомическим данным — 1,5%, соотношение по полу (мальчик:девочка) 2—4:1 [3]. Без операции на первом году жизни умирают 55—67%, а к 10 годам — до 90% детей [4—7].
Первоначально считалось, что ведущим механизмом развития ЕЖС является агенезия межжелудочковой перегородки. Однако исследования, проведенные R. Van Praagh с соавт. (1964), показали, что данный механизм не является универсальным, так как представляет один из вариантов возникновения ЕЖС, а с точки зрения эмбриогенеза и анатомии этот порок возникает тогда, когда происходит задержка развития одного или обоих желудочков сердца [8].
Многообразие анатомических вариантов ЕЖС и сопутствующих ему ВПС объясняют большое число предложенных классификаций. Наибольшее применение получила классификация порока R. Van Praagh с соавт. (1964), в основу которой положены анатомическое строение желудочковой камеры и характер взаимоотношения магистральных сосудов [8]. Согласно этой классификации, выделяют 4 типа ЕЖС (А, B, C, D).
При типе А (78%) единственный желудочек представлен миокардом левого желудочка (толстая стенка с множеством тонких трабекул), приточный отдел правого желудочка отсутствует, но имеется небольшая рудиментарная камера выводного тракта правого желудочка (миокард инфундибулярного отдела) — выпускник. Последний сообщается с единственным желудочком через бульбовентрикулярное отверстие; в полость предсердий выпускник выхода не имеет. Папиллярные мышцы обоих атриовентрикулярных клапанов располагаются на одной стороне желудочка.
При типе В (5%) весь миокард имеет строение правого желудочка (тонкий миокард и несколько грубых трабекул), выпускника нет. Миокард у больных с ЕЖС типа С (7%) имеет признаки строения как правого, так и левого желудочка (общий желудочек), межжелудочковая перегородка отсутствует или имеется ее рудиментарный зачаток, но развит гипертрофированный наджелудочковый гребень, разделяющий пути оттока из желудочка.
Тип D (10 %) не имеет дифференцировки миокарда (неопределенная структура), нет ни выпускника, ни межжелудочковой перегородки. Каждый из анатомических типов порока может сопровождаться нормальным (I тип), D (право-)-транспозиционным (II тип — сосуды расположены, как при полной транспозиции) или L (лево-)-транспозиционным (III тип — сосуды расположены, как при корригированной транспозиции) положением аорты относительно легочного ствола (рис. 1).
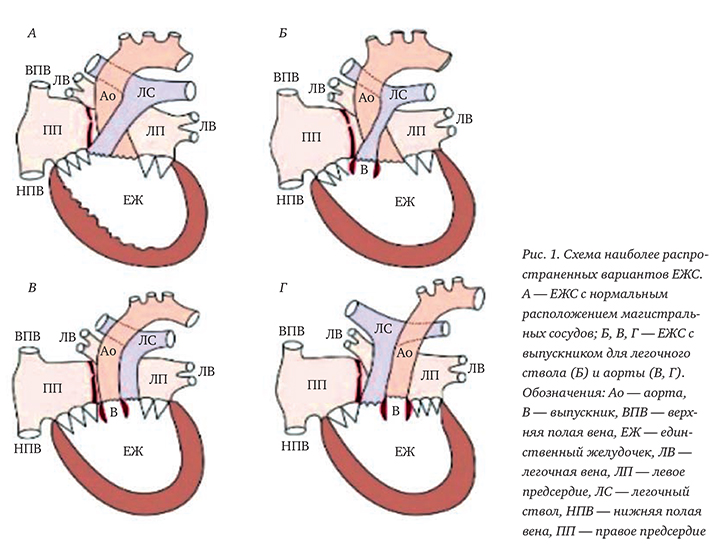
Наиболее распространенным (74—79%) типом порока является единственный желудочек с выпускником для аорты и L-транспозиционным положением магистральных сосудов (тип А III). Все варианты могут встречаться в условиях нормального, обратного и неопределенного расположения внутренних органов [2, 4].
Из сопутствующих пороков сердца следует отметить стеноз легочной артерии (64%), дефект межпредсердной перегородки (40%). Реже встречается отрытый артериальный проток, коарктация аорты [3, 5].
Внутриутробно порок существенно гемодинамику не нарушает, поэтому дети могут рождаться с нормальной массой и длиной тела. Манифестация порока и особенности клинической картины зависят от сопутствующих ВПС [3]. Ведущими клиническими симптомами ЕЖС являются цианоз и одышка.
Цианоз наиболее часто развивается с рождения или вскоре после рождения. Более выраженный и стойкий цианоз встречается при стенозе легочной артерии. При отсутствии стеноза легочной артерии цианоза может и не быть, отмечается лишь резкая бледность кожных покровов, но на втором году жизни в связи с развитием застойной сердечной недостаточности и застоя в малом круге кровообращения цианоз появляется и становится более выраженным.
Одышка в большей степени встречается при усиленном легочном кровотоке и соответствует большому внутрисердечному сбросу крови слева направо. В таких случаях нередки приступы одышки в покое. При отсутствии одышки в покое возможно ее развитие при умеренной нагруз...












