Трудный диагноз в педиатрии №3 / 2016
Глава 2. Синдром Жёна: описание серии наблюдений и обзор литературных данных
Синдром Жёна (СЖ, синонимы: торакоасфиктическая дистрофия (ТАД), асфиктическая дисплазия грудной клетки, код OMIM 208500) — редкое генетически гетерогенное заболевание, наследуемое по аутосомнорецессивному типу, характеризующееся развитием генерализованной остеохондродисплазии, аномалиями костной системы, поражением внутренних органов и глаз. Эпонимное название заболевания происходит от фамилии французского педиатра M. Jeune, который в 1955 году с соавт. впервые описал ТАД [1].
По данным J.D. Phillips и соавт. (2008), распространенность данного заболевания варьирует от 1:100000 до 1:130000 новорожденных [2]. Этиология СЖ гетерогенна. Длительное время считалось, что причиной данного заболевания является мутация, расположенная в локусе хромосомы 15q13 [3]. В настоящее время СЖ расценивается как генетически гетерогенное расстройство. Так, по данным P.L. Beales и соавт. (2007), генетические мутации, приводящие к возникновению CЖ, могут локализоваться в гене IFT80 в локусе хромосомы 3q25.33 [4]. В современной литературе также представлены данные об ассоциации синдрома Жёна с мутациями в генах DYNC2H1(11q22.3), WDR19 (4p14), TTC21B (2q24.3) [5—7]. Все эти гены, как и ген IFT80, играют важную роль в функционировании цилий в организме млекопитающих [4, 5, 7]. Ниже впервые в России описана серия наблюдений семи пациентов, повторно госпитализировавшихся в МДГКБ и другие стационары г. Москвы с данным синдромом.
Под нашим наблюдением в период с 2010-го по 2015 год находилось 7 пациентов с таким редким заболеванием, 2 мальчика и 5 девочек, родившихся на 24—40 неделе гестации (32±5,1) с массой тела при рождении 485—3480 г (1796±1225,9 г). Пятеро из них были недоношенными (табл. 1). Возраст детей варьировал от 4-x месяцев до 4-х лет, трое пациентов умерли в возрасте 5, 11 месяцев и в 1 год 9 месяцев.
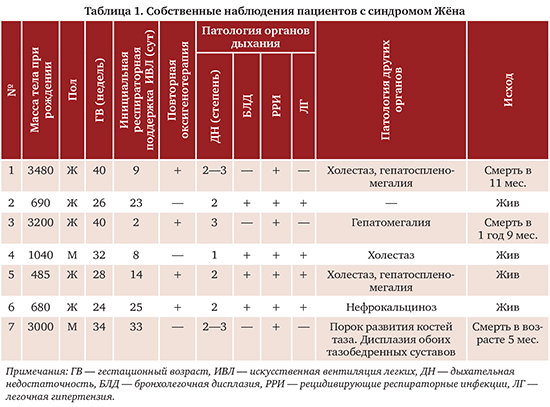
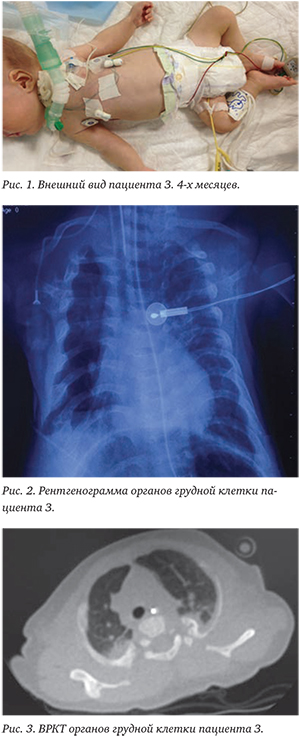
Обследование всех пациентов включало клинический осмотр, антропометрические измерения, стандартные гематологические, биохимические исследования, рентгенографию органов грудной клетки, допплеровскую эхокардиографию (Эхо-КГ), ультразвуковое исследование (УЗИ) органов брюшной полости и почек, двум пациентам была проведена высокоразрешающая компьютерная томография (ВРКТ) органов грудной клетки. В неонатальном периоде у всех детей наблюдались дыхательные нарушения, требовавшие проведения респираторной терапии. В качестве инициальной респираторной поддержки всем новорожденным проводилась искусственная вентиляция легких (ИВЛ) с переходом на постоянное положительное давление в дыхательных путях через носовые катетеры (NCPAP) в течение 2—33 (16,3±9,2) суток, у четырех пациентов сформировалась тяжелая бронхолегочная дисплазия (БЛД). Четверо детей после выписки со II этапа выхаживания нуждались в домашней кислородотерапии, у трех из них была БЛД. У всех пациентов отмечались частые рецидивирующие респираторные инфекции, явившиеся причиной регоспитализаций с развитием тяжелой дыхательной недостаточности (ДН), требовавшей дополнительной оксигенации, пяти детям проводилась повторная ИВЛ.
 Клинически у всех пациентов были обнаружены отставание роста окружности грудной клетки, неравномерное укорочение конечностей, у трех детей печень и селезенка пальпировались на 3—4 сантиметра ниже края реберной дуги. По данным антропометрии, рост всех пациентов был ниже 50 центиля. Окружность головы при рождении составляла 33, 22, 32, 28, 22,5, 24, 34 см, окружность грудной клетки 31, 19, 30, 22, 17, 18, 29 см соответственно. У пяти пациентов окружность головы в возрасте 10 месяцев составляла 46, 36, 45, 40, 35 см, грудной клетки — 41, 33, 42, 37, 33 см соответственно. Двое детей из нашего наблюдения не достигли возраста 10 месяцев, окружность головы в возрасте 6 и 4 месяцев составила 33 и 40 см, грудной клетки 29 и 33 см соответственно. Известно, что в норме в возрасте 3 месяцев эти показатели сравниваются и в течение всей жизни преобладают показатели окружности грудной клетки. У наблюдавшихся пациентов с СЖ в любом возрасте окружность головы преобладала над окружностью грудной клетки. У всех детей отмечалась гипотрофия 2—3 степени и задержка темпов психомоторного развития.
Клинически у всех пациентов были обнаружены отставание роста окружности грудной клетки, неравномерное укорочение конечностей, у трех детей печень и селезенка пальпировались на 3—4 сантиметра ниже края реберной дуги. По данным антропометрии, рост всех пациентов был ниже 50 центиля. Окружность головы при рождении составляла 33, 22, 32, 28, 22,5, 24, 34 см, окружность грудной клетки 31, 19, 30, 22, 17, 18, 29 см соответственно. У пяти пациентов окружность головы в возрасте 10 месяцев составляла 46, 36, 45, 40, 35 см, грудной клетки — 41, 33, 42, 37, 33 см соответственно. Двое детей из нашего наблюдения не достигли возраста 10 месяцев, окружность головы в возрасте 6 и 4 месяцев составила 33 и 40 см, грудной клетки 29 и 33 см соответственно. Известно, что в норме в возрасте 3 месяцев эти показатели сравниваются и в течение всей жизни преобладают показатели окружности грудной клетки. У наблюдавшихся пациентов с СЖ в любом возрасте окружность головы преобладала над окружностью грудной клетки. У всех детей отмечалась гипотрофия 2—3 степени и задержка темпов психомоторного развития.
На рентгенограммах органов грудной клетки и таза у всех пациентов были выявлены типичные признаки СЖ: узкая грудная клетка, горизонтально расположенные укороченные ребра, высокое расположение ключиц, имеющих вид «велосипедного руля», у одного пациента была обнаружена деформация костей таза и дисплазия обоих тазобедренных суставов.
У трех детей в неонатальном периоде отмечались явления холестаза, зарегистрированные по данным биохимических анализов крови. По данным УЗИ, гепатомегалия была обнаружена у двух пациентов, спленомегалия — у одного, нефрокальциноз — у одного ребенка. По данным ЭхоКГ, была зарегистрирована высокая легочная гипертензия (ЛГ) у трех детей, в терапии которой все получали












