Трудный диагноз в педиатрии №6 / 2018
Глава 6. Бронхиальная астма у детей с бронхолегочной дисплазией: два клинических наблюдения
Дискуссионным до сих пор является вопрос об отношении бронхиальной астмы (БА) и бронхолегочной дисплазии (БЛД). С одной стороны, имеются указания на высокую частоту БА в семейном анамнезе у детей с развившейся БЛД, в том числе и в особенности у пациентов с тяжелой БЛД, описывается трансформация БЛД в БА [1—3]. Бронхиальная астма в семейном анамнезе является фактором тяжелого течения БЛД [2]. Действительно, наличие бронхиальной гиперреактивности позволяет отнести детей с БЛД к группе риска по развитию БА [2, 4]. C другой стороны, БЛД, согласно рекомендациям Национальной программы
«Бронхиальная астма у детей» (2012) и Глобальной стратегии лечения и профилактики бронхиальной астмы GINА (2014), включена в группу заболеваний, с которыми проводится дифференциальный диагноз при подозрении на БА у детей [5, 6].
Имеются наблюдения, свидетельствующие, что дети, перенесшие БЛД, подвержены возникновению аллергических заболеваний, в том числе БА, не чаще, чем их здоровые сверстники [7]. Мало изученным остается вопрос о частоте и особенностях БА у детей, рожденных преждевременно, в том числе страдающих БЛД [8]. Исследователи до сих пор не пришли к единому мнению, может ли БА быть респираторным исходом БЛД или является коморбидным заболеванием. Описанная частота развития БА у детей с БЛД как в России, так и мире имеет сильную вариативность, от 0 до 51,6% [9—13]. Клиническую картину, особенности течения заболеваний, тактику ведения данной категории пациентов и терапию при одномоментном наличии БА и БЛД во всем мире изучают мало, ограничиваясь нередко единичными клиническими наблюдениями [14, 15].
Представляем два клинических наблюдения БА у детей с БЛД, наблюдавшихся и проходивших обследование в консультативнодиагностическом отделении с дневным стационаром (КДО с ДС) ДИКБ № 6 и МДГКБ Департамента здравоохранения г. Москвы.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 1
Девочка Н., 6 лет (09.09.2011 г.р.) наблюдалась в КДО с ДС ДИКБ № 6 по поводу БЛД. Ребенок от женщины 27 лет с отягощенным акушерско-гинекологическим анамнезом (поликистоз яичников, истмико-цервикальная недостаточность, бесплодие) от 1 беременности, протекавшей с угрозой прерывания в I триместре, на фоне экстракорпорального оплодотворения. Роды самостоятельные, преждевременные на 26 нед. Масса тела при рождении 970 г, длина 36 см, оценка по шкале Апгар 4/6 баллов. Состояние при рождении тяжелое за счет дыхательной недостаточности, инфекционного токсикоза. Интубирована в родильном зале, с рождения на ИВЛ с жесткими параметрами. Вводился куросурф. Девочка после рождения длительно (2 мес 29 дней) находилась на искусственной вентиляции легких (ИВЛ), сформировала тяжелую БЛД. В неонатальном периоде перенесла генерализованную инфекцию (пневмонию, энтероколит, инфекцию мочевой системы), находилась на стационарном лечении в отделении патологии новорожденных с 09.09 по 14.02.2012 (рис. 1).
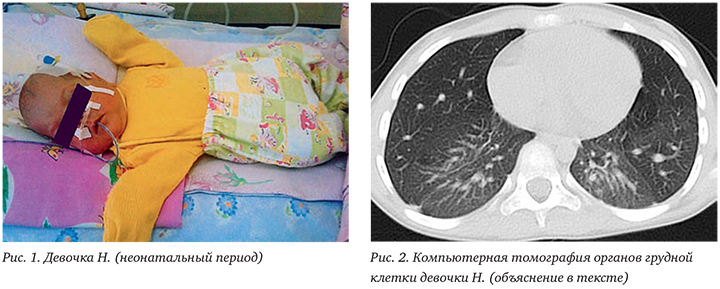
До 1 года получала кислородотерапию на дому с помощью концентратора кислорода. С рождения до 3 лет нуждалась в постоянной терапии ингаляционными глюкокортикостероидами (ИГКС) и бронхолитическими препаратами. При неоднократных попытках снижения дозы ИГКС отмечалось резкое нарастание бронхообструктивного синдрома (БОС) и дыхательной недостаточности.
Госпитализировалась в ДИКБ № 6 с 19.02 по 20.02.2012 с ОРЗ, сопровождавшимся нетяжелым обострением БЛД.
В эпидсезон 2013—2014 гг. получила иммунизацию паливизумабом (5 введений).
Проведены обследования. Эхокардиография (ЭхоКГ) от 14.02.2014: расчетное давление в легочной артерии 35/6 мм рт.ст. (норма 30/10 мм рт.ст.), открытое овальное окно 3 мм. Дополнительная трабекула левого желудочка.
Рентгенография органов грудной клетки от 21.01.2014: выраженная гиперинфляция легких, пневматизация неравномерна (чередование буллезных вздутий и лентообразных уплотнений), легочный рисунок обогащен, деформирован, вилочковая железа умеренно расширена вправо, очаговоинфильтративные изменения не определяются, синусы свободны.
По данным компьютерной томографии (КТ) органов грудной клетки от 17.02.2014: КТкартина явлений пневмофиброза с ...












