Трудный диагноз в педиатрии №6 / 2018
Глава 9. Особенности течения сахарного диабета у детей раннего возраста. Клиническое значение генетических исследований для оптимизации терапии сахарного диабета у детей и подростков как фактор профилактики неотложных и критических состояний при сахарном
Клиническое значение генетических исследований для оптимизации терапии сахарного диабета у детей и подростков как фактор профилактики неотложных и критических состояний при сахарном диабете.
Сахарный диабет — это гетерогенная группа метаболических заболеваний, характеризующихся высоким уровнем глюкозы крови, который может проявляться в любом возрасте: от рождения до старости.
Успехи молекулярной генетики позволили идентифицировать генетические аномалии, связанные со многими верифицированными ранее клинически различными подтипами сахарного диабета (СД). Генетическая идентификация объясняет клиническую гетерогенность симптомов, основываясь на данных возраста манифестации СД, например, как при НД или MODY. В настоящее время достижения молекулярной генетики используются в клиническом обследовании для верификации точного диагноза с назначением правильной терапии для детей с СД. Учитывая высокую стоимость генетических исследований, они должны проводиться только после тщательного анализа всех клинико-метаболических данных пациента, с тем чтобы результат тестирования при подозрении на какой-либо конкретный диагноз был с максимальной вероятностью положительным.
В качестве примеров к изложенным литературным данным приводятся клинические случаи пациентов с различными формами моногенного СД, которые обследовались и лечились в отделении эндокринологии Морозовской детской городской клинической больницы Департамента здравоохранения г. Москвы (Морозовская ДГКБ ДЗМ).
КЛИНИЧЕСКИЙ СЛУЧАЙ
Транзиторный неонатальный сахарный диабет (НСД).
Ребенок Е.С., поступил в возрасте 3 дней переводом из роддома в отделение патологии новорожденных Морозовской ДГКБ ДЗМ.
Из анамнеза: родился на 39 нед, беременность 1 без патологических особенностей, матери 25 лет, здорова, роды первые срочные самостоятельные за 10 ч, без осложнений и патологических особенностей, родился мальчик весом 2650 г, длиной 55 см, закричал сразу, по Апгар 7—8 баллов, но через 8 ч после рождении ухудшение состояния, токсикоз, эксикоз, выявлена гипергликемия до 40 ммоль/л, начата симптоматическая терапия, в том числе инфузионная, инсулинотерапия, ребенок переведен в отделение патологии новорожденных Морозовской ДГКБ ДЗМ.
При поступлении: состояние тяжелое, вес 2500 г, рост 55 см, признаки выраженного эксикоза, гипорефлексия, анорексия, расстройства микроциркуляции, признаки морфофункциональной незрелости, признаки диабетического кетоацидоза (ДКА), гликемия в течение суток крайне лабильна от 15 до 40 ммоль/л, глюкозурия до 40—50 г/сут, выраженная ацетонурия, кислотно-щелочное состояние крови при поступлении: рН 7,15; ВЕ -23,5 (рис. 1).

 На основании данных анамнеза, осмотра, дообследования (специфических антител к бетаклеткам поджелудочной железы не обнаружено, С-пептид натощак снижен до 0,6 нг/мл, норма 0,78—1,89 нг/мл) был поставлен клинический диагноз «НСД в фазе ДКА». Начато специфическое лечение, включающее инфузионную терапию глюкозо-солевыми растворами, инсулинотерапию по показателям гликемии. Неонатальный диабет крайне лабилен по показателям углеводного обмена, пациенты относительно инсулинорезистентны, требуют больших доз инсулина. Особенности течения этого редкого заболевания на фоне инсулинотерапии были визуализированы с помощью прибора непрерывного мониторинга гликемии CGMS (рис. 2).
На основании данных анамнеза, осмотра, дообследования (специфических антител к бетаклеткам поджелудочной железы не обнаружено, С-пептид натощак снижен до 0,6 нг/мл, норма 0,78—1,89 нг/мл) был поставлен клинический диагноз «НСД в фазе ДКА». Начато специфическое лечение, включающее инфузионную терапию глюкозо-солевыми растворами, инсулинотерапию по показателям гликемии. Неонатальный диабет крайне лабилен по показателям углеводного обмена, пациенты относительно инсулинорезистентны, требуют больших доз инсулина. Особенности течения этого редкого заболевания на фоне инсулинотерапии были визуализированы с помощью прибора непрерывного мониторинга гликемии CGMS (рис. 2).
На фоне проведенного обследования и лечения состояние ребенка улучшилось, ДКА купирован, достигнута клинико-метаболическая компенсация НСД. Родители ребенка обучены в «Школе диабета», ознакомлены с принципами самоконтроля, диетотерапии, инсулинотерапии. В возрасте 1 мес ребенок выписан домой в удовлетворительном состоянии с весом 3700 г, длиной 61 см на болюс-базисной схеме инсулинотерапии с помощью инсулина короткого действия регуляр и инсулина средней продолжительности действия NPH в суммарной дозе 1,5 ЕД/кг веса.
Особенностью НСД при всей тяжести манифестации заболевания является возможность его транзиторного течения. Ремиссия наступает через 6—12 мес после манифестации. Возможна последующая манифестация нарушения углеводного обмена как сахарного диабета 1 типа в препубертатном или пубертатном возрасте. В возрасте 2 мес ребенку было проведено повторное исследование С-пептида, антител к бета-клеткам поджелудочной и определение проинсулина с генотипированием локусов HLA. Результаты представлены в таблице 1.
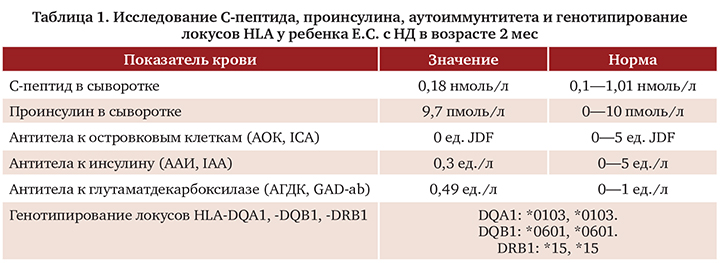
По данным приведенного дообследования выявились нормальные уровни С-пептида и проинсулина, что исключило недостаточность базальной секреторной активности бетаклеток на момент обследования. Также вторично было диагностировано отсутствие всех видов антител, устраняющих гуморальную аутоиммунную реакцию против бета-клеток с примерной вероятностью 98%, не исключая клеточную аутоиммунную реакцию. По результатам типирования генов локуса HLA (IDDM-1) обнаруженные аллельные варианты показали, что обследуемый гомозиготен по всем аллелям. Это делает возможным только один генотип пациента:
DQA1*0103-DQB1*0601-DRB1*15||DQA1*0103-DQB1*0601-DRB1*15.
За счет наличия аллелей DRB1*15 в гомозиготном состояни...












