Акушерство и Гинекология №8 / 2023
Хемомикробиомный анализ миоинозитола, D-хироинозитола, фолиевой кислоты и пироглутамат-аниона марганца в контексте поддержки женской репродуктивной сферы
Федеральный исследовательский центр «Информатика и управление» Российской академии наук, Москва, Россия
Актуальность: Миоинозитол (МИ) и D-хироинозитол (ДХИ) используются в терапии заболеваний женской репродуктивной сферы и могут поддерживать рост полезной микробиоты.
Цель: Сравнительный хемомикробиомный анализ МИ, ДХИ и их синергистов – фолиевой кислоты (ФК) и пироглутамата марганца (ПМ) при приеме внутрь.
Материалы и методы: Хемомикробиомный анализ включал оценки накопления молекул в различных тканях, площади под кривой роста бактерий-комменсалов (AUC), воздействия на метаболические пути микробиоты и минимальных ингибирующих концентраций (MIC) для штаммов патогенных бактерий.
Результаты: Установлено синергидное воздействие МИ, ДХИ, ФК и ПМ на микробиом человека. Наибольший вклад в поддержку полезной микробиоты вносил МИ (AUC 0,74±0,17 у.е.), за ним следовали ДХИ и ФК (AUC в диапазоне 0,68–0,71 у.е.). Нормобиотой наиболее активно перерабатываются ФК (19,3±10,5%) и ДХИ (15,3±11,5%), а наименее активно – МИ (13,7±7,7%) и ПМ (13,2±11,3%). Наиболее активными бактериями – метаболизаторами исследованных веществ являлись различные штаммы Bacteroides fragilis (28–34%). В соответствии с результатами хемомикробиомного анализа МИ, ДХИ, ФК и ПМ могут проявлять пребиотические свойства и поддерживать рост комменсалов из родов бактероидов, стрептококков, бифидобактерий. МИ, ДХИ и ФК оказывали значительную поддержку росту бифидобактерий (AUC более 0,80). Проявляя пребиотические свойства, МИ, ДХИ и ФК могут поддерживать рост нормобиоты, важной для регуляции углеводного обмена. Исследованные вещества (в особенности ДХИ) могут тормозить рост патогенных микроорганизмов – Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae (значения MIC порядка 20–30 мкг/мл).
Заключение: Проведенный анализ позволил установить, что совместный прием МИ, ДХИ, ФК и ПМ способствует поддержке здорового микробиома, что важно для женщин, особенно в период беременности и перименопаузы.
Вклад авторов: Торшин И.Ю., Громов А.Н., Громова О.А. – идея исследования, сбор и обработка материала, написание текста, редактирование.
Конфликт интересов: Авторы заявляют об отсутствии необходимости раскрытия конфликта интересов в отношении данной публикации.
Финансирование: Работа выполнена без спонсорской поддержки.
Обмен исследовательскими данными: Данные, подтверждающие выводы этого исследования, доступны по запросу у автора, ответственного за переписку, после одобрения ведущим исследователем.
Для цитирования: Торшин И.Ю., Громов А.Н., Громова О.А. Хемомикробиомный анализ миоинозитола, D-хироинозитола, фолиевой кислоты и пироглутамат-аниона марганца в контексте поддержки женской репродуктивной сферы.
Акушерство и гинекология. 2023; 8: 154-164
https://dx.doi.org/10.18565/aig.2023.189
Препараты на основе многоатомных спиртов инозитолов (стереоизомеров циклогексан-1,2,3,4,5,6-гексола) используются для компенсации инсулинорезистентности, особенно у пациенток с нарушениями менструального цикла и функции яичников. Попадая в клетку, стереоизомеры инозитолов фосфорилируются с образованием специфических производных – инозитолфосфатов [1, 2]. Характеризуясь уникальными ролями во внутриклеточной передаче сигнала, инозитолфосфаты принципиально необходимы для обеспечения адекватного уровня чувствительности клеток к различным гормонам (инсулину, фолликулостимулирующему гормону (ФСГ), лютеинизирующему гормону (ЛГ) и др.), факторам роста и нейротрансмиттерам. Известно, что резистентность клеток яичников к инсулину, ЛГ, ФСГ ассоциирована с нарушениями менструального цикла [1].
Систематический анализ молекулярно-физиологических эффектов инозитолов показал, что миоинозитол (МИ) гораздо более изучен, чем D-хироинозитол (ДХИ) и другие формы инозитолов. Известно более 200 инозитолфосфат-зависимых белков, необходимых для передачи внутриклеточных сигналов [3, 4]. Инозитолфосфат-зависимые белки вовлечены в поддержку функционирования репродуктивной системы, менструального цикла, сигнального каскада инсулина, почек, печени, центральной нервной системы и соединительной ткани. МИ принципиально важен для профилактики фолат-резистентных врожденных пороков развития плода (ВПР) [1].
В препаратах используется, как правило, только один стереоизомер – МИ. Систематический анализ биологических ролей и фармакологических свойств ДХИ показал, что ДХИ входит в состав инозитоловых фосфогликанов, являющихся медиаторами действия инсулина. Обмен ДХИ и МИ нарушается на фоне инсулинорезистентности, в т.ч. у пациенток с синдромом поликистоза яичников и гиперандрогенией. Хемореактомный анализ стереоизомеров инозитола указал на существенно различные профили фармакологического действия МИ и ДХИ [5]. Дотации ДХИ и МИ способствуют повышению чувствительности клеток к инсулину, нормализации метаболизма андрогенов и повышению эффективности метформина. Дополнение комбинации МИ+ДХИ фолиевой кислотой (ФК) и пироглутаматом марганца (ПМ) может повысить эффективность лечения инсулинорезистентности и профилактики ВПР [6]. Пироглутамат-анион, в частности, может проявлять дополнительные нейропротекторные, антигипертензивные, седативные и антидепрессивные свойства [7].
Инозитолы, фолаты и ПМ также могут проявлять пребиотические свойства, способствуя росту полезной микробиоты желудочно-кишечного тракта (ЖКТ). Хемомикробиомные скрининги препаратов, проводимые на основе современных информационных технологий анализа больших данных [8, 9], позволяют оценивать эффекты веществ на различные типы бактерий-комменсалов человека и на различные штаммы бактериальных патогенов [10–12]. Учет воздействия на микробиоту ЖКТ важен для оценки баланса «эффективность-безопасность» средств, принимаемых per os, особенно длительными курсами (месяцы). Оценка воздействия рассматриваемых микронутриентов на микробиоту человека также является важной составляющей действия этих молекул.
Цель настоящей работы: сравнительный хемомикробиомный анализ МИ, ДХИ, ФК и ПМ.
Материалы и методы
Химические структуры исследованных молекул приведены на рисунке 1. Хемомикробиомный анализ основан на хемоинформационном подходе [10], теории анализа размеченных графов, теории метрического анализа данных [8], комбинаторной теории разрешимости, топологической теории анализа плохоформализованных задач и новейших методов прогнозирования значений числовых переменных [9].
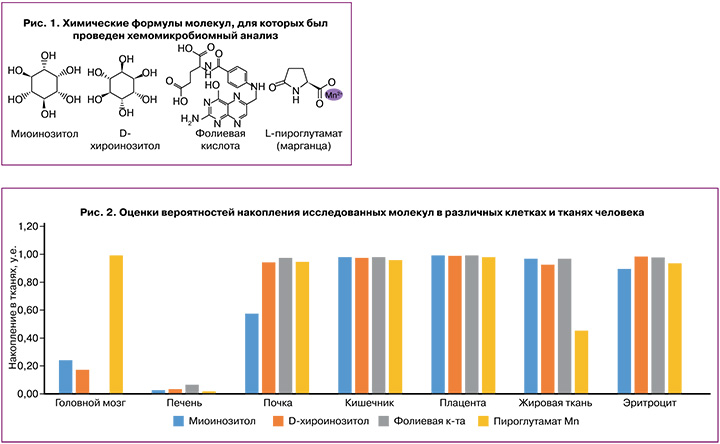
Для каждой из исследованных молекул были получены оценки значений площади под кривой роста (AUC) для репрезентативной выборки микробиоты человека, включившей 38 бактерий-комменсалов (в т.ч. различные виды бифидо- и лактобактерий) и более 152 бактериальных патогенов, которые более подробно описаны в работах [10–13].
Выборка микробиома включает 21 род бактерий и представляет 78% микробиома ЖКТ. Большинство исследованных штаммов были комменсалами, обнаруженными при относительной численности 1% или более и распространенности не менее 50% в пробах фекалий от здоровых добровольцев с трех континентов. На этой выборке штаммов микробиома для всех молекул, представленных на рисунке 1, были оценены значения AUC, значения стандартных отклонений значений AUC и значения Р статистической достоверности отличий AUC от контроля (стандартная среда выращивания бактерий). На основании информации в базах данных Human Microbiome Project [14], iHMP [15], PubChem [16] оценивались значения минимальных ингибирующих концентраций (MIC) для 152 штаммов патогенных бактерий.
Результаты и обсуждение
Проведенный в настоящей работе хемомикробиомный анализ включил оценки: (1) накопления исследуемых молекул в различных тканях; (2) влияния на площадь под кривой роста бактерий комменсалов (AUC); (3) воз...












