Акушерство и Гинекология №8 / 2016
Идентификация ассоциированных с преэклампсией микроРНК методом глубокого секвенирования и количественной полимеразной цепной реакции в реальном времени
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Сравнительный анализ профиля экспрессии микроРНК в образцах плаценты и плазмы периферической крови беременных с физиологически протекающей беременностью и преэклампсией.
Материал и методы. Использован метод глубокого секвенирования (HiSeq 2000, Illumina) микроРНК в образцах плаценты и плазмы крови практически здоровых женщин и беременных с ранней и поздней преэклампсией с последующей валидацией полученных данных методом количественной ОТ-ПЦР в реальном времени (StepOnePlusTM).
Результаты исследования. Выявлено достоверное снижение уровня экспрессии hsa-miR-532-5p, -423-5p, -127-3p, -376a-5p, -539-5p, -519a-3p в плаценте и достоверное повышение уровня экспрессии hsa-miR-423-5p и -519a-3p в плазме крови беременных с преэклампсией более чем в два раза. Впервые выявлена ассоциация изменения уровня экспрессии перечисленных микроРНК с наличием преэклампсии у беременных, за исключением miR-519a-3p, изменение транскрипционного профиля которой при преэклампсии уже было продемонстрировано. Согласно построенной по данным исследования модели логистической регрессии вероятность развития ранней преэклампсии повышается с увеличением уровня экспрессии miR-423-5p в плазме крови беременных. Данное наблюдение может стать основой создания тестовой системы по скринингу беременных для ранней диагностики преэклампсии до клинической манифестации заболевания.
Заключение. Обнаруженные микроРНК являются потенциальными регуляторами сигнальных путей, участвующих в фолликулогенезе и стероидогенезе в яичниках, процессинге и презентации антигена, децидуализации эндометрия и сохранении беременности на ранних сроках гестации, реакции «трансплантат против хозяина», развитии аутоиммунных реакций, клеточной миграции и инвазии, фокальной адгезии и регуляции актинового цитоскелета, внутриклеточном транспорте кальция и кальций-зависимых реакциях, активации комплемента и коагуляции крови, регулируемой альдостероном реабсорбции натрия, ренин-ангиотензиновой системе, а также в р53- и прохибитин-опосредованном клеточном апоптозе, что в целом укладывается в общепринятое представление об участии данных сигнальных путей в патогенезе преэклампсии.
Преэклампсия – мультисистемное патологическое состояние, возникающее у 3–5% беременных женщин и являющееся одной из ведущих причин материнской и перинатальной смертности [1]. Как правило, заболевание манифестирует во второй половине беременности с классической триадой симптомов у беременной: гипертензия, протеинурия и периферические отеки [2]. Хотя этиология и патогенез преэклампсии остаются до конца не выясненными, патогенез преэклампсии, согласно современным представлениям, принято считать двухстадийным процессом [3]. Первая стадия заключается в нарушениях процессов плацентации, в основном в результате дезадаптации локального иммунного ответа матери в отношении фетальных тканей, а также нарушения фенотипической трансформации клеток цитотрофобласта при инвазии ими спиральных маточных артерий. Во время эмбрионального развития млекопитающих происходит дифференцировка трофэктодермы в цитотрофобласты, функционирующие в качестве стволовых клеток на ранних стадиях развития плаценты [4] и дифференцирующиеся в клетки ворсин хориона различной специализации, а именно: 1) не пролиферирующие многоядерные синцитиотрофобласты, находящиеся в непосредственном контакте с кровью матери, синтезирующие хорионический гонадотропин, плацентарный лактоген и стероидные гормоны, экспрессирующие HLA-G и предотвращающие развитие реакции отторжения фетальных тканей [5]; 2) вневорсинчатые трофобласты, инвазирующие строму матки и экспрессирующие отцовские антигены, обусловливая воспалительный ответ в децидуальной ткани, вызывая в ней процессы апоптоза и облегчая инвазию трофобласта и ремоделирование спиральных маточных артерий [6]. Инвазирующий трофобласт после смены фенотипа с эпителиального на эндотелиальный встраивается в сосудистую стенку спиральных артерий, обусловливая снижение сосудистого сопротивления и значительное повышение кровотока [7]. Индуцированное трофобластом ремоделирование спиральных артерий является ключевым процессом в развитии беременности, поскольку недостаточная фенотипическая трансформация клеток трофобласта и ограниченная их инвазия, что характерно для преэклампсии, приводит к сниженному кровотоку в системе мать-плод и малому объему плаценты, что не отвечает потребностям растущего плода [8]. В результате развивается ишемия/гипоксия плаценты с последующим нарастанием апоптоза и некроза синцитиотрофобласта и выбросом в кровоток матери микровезикул и клеточных обломков трофобласта [9], а также повреждающих факторов плацентарного происхождения, таких как растворимая fms-подобная тирозинкиназа 1 (sFlt1) провоспалительные цитокины, антитела к рецепторам ангиотензина 1, растворимый эндоглин, фактор некроза опухолей α, интерлейкин 1, фибронектин, фактор свертывания крови VIII [10]. В целом, эти изменения приводят к наступлению второй стадии развития преэклампсии, характеризующейся системной эндотелиальной дисфункцией во многих органах и системах, включая сердечно-сосудистую систему, почки, печень, мозг и др. [11]. В конечном итоге, клиническая манифестация преэклампсии происходит после 20 недели гестации с проявлением симптомов гипертензии и протеинурии на фоне нарушенной клубочковой фильтрации и повышенной проницаемости сосудов в периферических тканях [12].
Применение различных молекулярно-биологических подходов позволило идентифицировать целый спектр дифференциально экспрессированных генов в плаценте беременных с преэклампсией по сравнению с женщинами c физиологическим течением беременности [13, 14], однако генетические и эпигенетические механизмы регуляции экспрессии выявленных генов недостаточно изучены. МикроРНК (мкРНК) представляют собой класс некодирующих малых РНК длиной 21–25 нуклеотидов, осуществляющих эпигенетический контроль уровня экспрессии генов-мишеней в основном на посттранскрипционном уровне, дестабилизируя мРНК и ингибируя трансляцию белка [15]. В целом ряде исследований выявлена роль мкРНК в регуляции развития и функции плаценты. В одной из работ обнаружены изменения уровня экспрессии мкРНК кластеров miR-17-92, C14MC, miR-371-3, C19MC, кластера miR-29, семейства let-7, miR-195 и miR-181c в плаценте в зависимости от сроков гестации [16]. Широкомасштабные исследования экспрессии генов мкРНК в плаценте беременных с физиологическим течением беременности и беременных с преэклампсией [17–19] и преждевременными родами [20] позволило идентифицировать более десятка дифференциально экспрессированных мкРНК в каждом исследовании, причем списки выявленных мкРНК были различными в каждом исследовании с минимальными совпадениями. Причины данных несоответствий, по-видимому, связаны с использованием различных тестовых систем для анализа только определенного набора мкРНК или различиями в топологии исследуемого фрагмента ткани плаценты.
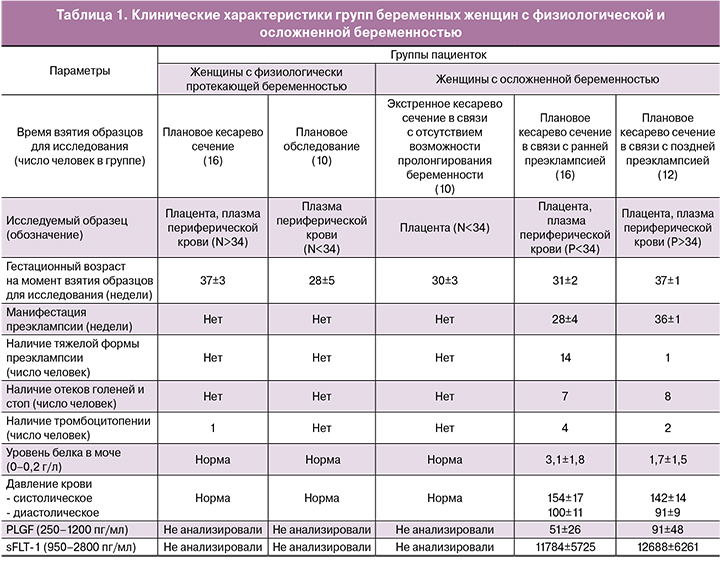
В связи с вышеизложенным, целью настоящего исследования было проведение скрининга мкРНК в ткани плаценты и плазме крови беременных женщин с ранней и...












