Кардиология №4 / 2014
«Идиопатические» аритмии: возможности комплексной нозологической диагностики и дифференцированного лечения
ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава РФ; ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова; НПФ «ДНК-технология», Москва
Цель исследования — установить нозологическую природу «идиопатических» аритмий (ИА) с помощью комплексного клинико-морфологического обследования больного и оценить эффективность дифференцированного этиотропного и патогенетического лечения. Обследованы 190 больных (средний возраст 45,33±14,84 года, 117 женщин) с ИА: мерцанием (38,9%) и трепетанием (11,1%) предсердий, наджелудочковой (44,7%) и желудочковой (55,3%) экстрасистолией, «пробежками» желудочковой тахикардии (15,8%), атриовентрикулярной (АВ) блокадой (22,6%) и др. Среднее число антиаритмических препаратов (ААП), назначенных больным, составило 3 (от 1 до 8). Проведены холтеровское мониторирование электрокардиограммы, эхокардиография, определение уровня антикардиальных антител (97,4%) и маркеров кардиотропных вирусов (87,4%), тредмил-тест (26,3%), чреспищеводная стимуляция предсердий (12,1%), электрофизиологическое исследование (10%), мультиспиральная компьютерная томография (22,1%), магнитно-резонансная томография (21,6%), сцинтиграфия (27,4%), коронарография (10%), эндомиокардиальная биопсия (10%), ДНК-диагностика (8,9%). При биопсии в 78,9% случаев выявлена иммуновоспалительная патология (мио/эндокардит, системный/миокардиальный васкулит), в 21,1% — генетическая. С данными биопсии наиболее тесно коррелировал уровень антикардиальных антител (в том числе специфический антинуклеарный фактор). На основе сопоставления данных биопсии и комплексного обследования больных разработан алгоритм нозологической диагностики при ИА. Все больные распределились по нозологиям следующим образом: 1) хронический инфекционно-иммунный миокардит (n=144; 75,7%), морфологически верифицированный у 14, вирусный у 27; 2) генетическая кардиомиопатия (n=15; 7,9%), морфологически верифицированная у 4, вирус-позитивная у 1 (аритмогенная дисплазия правого желудочка, некомпактный миокард, болезнь Фабри, синдром Бругада, неуточненная). У 4 больных выявлены мутации в генах плакофиллина-2, десмоглеина, десмина, α-галактозидазы А (диагностика продолжается); 3) сочетание генетических заболеваний с миокардитом (n=18; 9,5%), в том числе вирусным у 3 больных; 4) изолированная миокардиодистрофия (n=3; 1,6%) тонзилогенная, дисгормональная; 5) собственно ИА (n=10; 5,3%). Терапия миокардита включала противовирусные (43,2%), иммуносупрессивные (76,3%) препараты — плаквенил 200 мг/сут, метипред 16 (16; 32) мг/сут, азатиоприн 118,8±37,5 мг/сут; нестероидные противовоспалительные средства (34%), габриглобин (1,2%). Проводилась кардиотропная и антиаритмическая терапия. Лишь у больных с миокардитом оказалась возможной отмена ААП (16,7%). Потребность в хирургическом лечении (электрокардиостимуляция, имплантация кардиовертера-дефибриллятора, радиочастотная абляция — РЧА) у больных с генетическими аритмиями (39,4%) и ИА (53,8%) была больше, чем у пациентов с миокардитом (16%). В большинстве случае этиология ИА может быть установлена. Основными причинами являются иммуновоспалительные заболевания (75,7% по данным комплексного обследования и 78,9% по данным биопсии), генетические кардиомиопатии (несколько чаще при желудочковых аритмиях и АВ блокаде II—III степени) и их сочетание. Терапия миокардита позволяет повысить антиаритмическую эффективность лечения, полностью отменить ААП у отдельных больных, снизить потребность в хирургическом лечении, оптимально подготовить пациентов к проведению РЧА.
Термин «идиопатические» аритмии (ИА) подразумевает нарушения ритма и проводимости у больных (как правило, моложе 60 лет) без структурных заболеваний сердца или, что точнее, с неустановленной причиной. Вместе с тем наличие аритмии свидетельствует об изменении электрических свойств сердца, в основе которого могут лежать такие латентные и трудно диагностируемые состояния, как хронический миокардит, различные генетические кардиомиопатии, миокардио-дистрофии (МКД), амилоидоз и пр. Поэтому термин ИА мы берем в кавычки и ставим цель по возможности выявить этиологию аритмии. В предшествующих наших публикациях отражены результаты эндомиокардиальной биопсии (ЭМБ) у больных с ИА, которая при определенном отборе оказалась высокоинформативной и позволила разработать критерии неинвазивной нозологической диагностики [1—3]. Данная работа является продолжением исследования с использованием установленных критериев у широкого круга больных.
Цель исследования: установить нозологическую природу ИА с помощью комплексного клинико-морфологического обследования и оценить эффективность дифференцированного этиотропного и патогенетического лечения.
Материал и методы
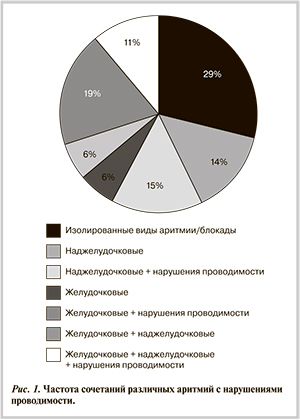
В исследование включены 190 больных 16—76 лет (средний возраст 45,3±14,8 года, 117 женщин) с различными аритмиями (табл. 1), главным образом, наджелудочковой и желудочковой экстрасистолией (НЖЭ/ЖЭ) и мерцательной аритмией (МА); более чем у 2/3 пациентов аритмии сочетались между собой и/или с нарушениями проводимости (рис. 1).
Критериями исключения были дилатация левого желудочка (ЛЖ) (конечный диастолический размер (КДР) ≥5,5 см), гипертрофия ЛЖ >14 мм, фракция выброса (ФВ) ЛЖ<50%, инфаркт миокарда, инфекционный эндокардит, операции на открытом сердце в анамнезе, пороки сердца, гипертрофическая и рестриктивная кардиомиопатия (КМП), верифицированные диффузные болезни соединительной ткани, системные васкулиты, тиреотоксическое сердце.
 Средний возраст, в котором начиналась аритмия, составил 40,5±14,6 года — 47,2±13,2 года у больных с МА, 20,4±3,1 года у больных с атриовентрикулярной (АВ) блокадой; давность аритмии составила 30,0 (10,0; 84,0) мес. У каждого больного было в среднем использовано 3 (от 1 до 8) антиаритмических препарата (ААП). Медиана числа НЖЭ составила 946 (250; 5050) в сутки, ЖЭ — 5404 (1184; 14778) в сутки. МА расценена как пароксизмальная, персистирующая и постоянная у 79,7, 14,9 и 5,4% больных соответственно. Стенокардия имелась у 23,2% больных и не отражала наличие ишемической болезни сердца — ИБС (см. ниже); ожирение отмечено у 35,3% (в основном 1-й степени), артериальная гипертония (АГ) — у 41,6% (у 16,8% 3-й степени, но в отсутствие признаков гипертрофии ЛЖ, его диастолической дисфункции, а также анамнестической связи АГ и аритмии); минимальные симптомы сердечной недостаточности (СН) — у 14,2%, в том числе у пациентов с МА. Данные факторы ни в одном случае не могли рассматриваться как ведущая причина аритмии.
Средний возраст, в котором начиналась аритмия, составил 40,5±14,6 года — 47,2±13,2 года у больных с МА, 20,4±3,1 года у больных с атриовентрикулярной (АВ) блокадой; давность аритмии составила 30,0 (10,0; 84,0) мес. У каждого больного было в среднем использовано 3 (от 1 до 8) антиаритмических препарата (ААП). Медиана числа НЖЭ составила 946 (250; 5050) в сутки, ЖЭ — 5404 (1184; 14778) в сутки. МА расценена как пароксизмальная, персистирующая и постоянная у 79,7, 14,9 и 5,4% больных соответственно. Стенокардия имелась у 23,2% больных и не отражала наличие ишемической болезни сердца — ИБС (см. ниже); ожирение отмечено у 35,3% (в основном 1-й степени), артериальная гипертония (АГ) — у 41,6% (у 16,8% 3-й степени, но в отсутствие признаков гипертрофии ЛЖ, его диастолической дисфункции, а также анамнестической связи АГ и аритмии); минимальные симптомы сердечной недостаточности (СН) — у 14,2%, в том числе у пациентов с МА. Данные факторы ни в одном случае не могли рассматриваться как ведущая причина аритмии.
Помимо стандартного обследования (в том числе определения уровня гормонов щитовидной железы) абсолютному большинству пациентов проведено определение:
1) IgG к вирусам герпетической группы, Коксаки В и ДНК вирусов герпеса 1, 2 и 6-го типов, вируса Эпштейна—Барр (ВЭБ), varicellae-zoster virus, цитомегаловируса в крови методом полимеразной цепной реакции (лаборатория «ДНК-технология», центр молекулярной диагностики НИИ эпидемиологии);
2) антикардиальных антител (АТ) в 3 лабораториях: «МедБиоСпектр» (IgM и IgG к миокардиальному антигену, в норме 1:100); «Иммункулус» (естественные аутоантитела (аутоАТ) класса IgG к цитоплазматическому белку кардиомиоцитов (КМЦ) CoS05—40 и белку мембран CoM015—15; NO-синтетазе; β1-адренорецепторам, в норме от –30 до +20); лаборатории иммуногистохимии Федерального научного центра трансплантологии и искусственных органов им. акад. В.И. Шумакова: АТ к антигенам эндотелия, КМЦ, гладкой мускулатуры, волокон проводящей системы сердца (в норме 1:40), антинуклеарный фактор (АНФ) с антигеном сердца быка (в норме нет); использовали чистые АТ против IgG человека, меченные флюоресцеинизотиоцианатом, а также люминесцирующие сыворотки против IgG человека; учет проводили на микроскопах Leica («Laborlux», DM4000В) при увеличении 400 и 600.
Прочие инструментальные исследования выполняли индивидуально (табл. 2). Показания к ЭМБ и ее результаты представлены в нашей предшествующей публикации [3].
 В зависимости от диагноза проводилась базисная терапия.
В зависимости от диагноза проводилась базисная терапия.
В контрольную группу включен 51 человек (средний возраст 50,0±14,1 года, 31 женщина) — здоровые добровольцы, пациенты гастроэнтерологического профиля без заболеваний сердца, а также больные с ИБС, гипертрофической КМП, пороками сердца: уровень антикардиальных АТ определялся у 36 из них, вирусный геном в крови — у всех.
Проведение исследования (в том числе формы информированного согласия на ЭМБ и отдельные виды лечения) одобрено Межвузовским комитетом по этике.
Статистическая обработка результатов исследования осуществлялась с помощью программы SPSS 11.5.
Методы статистического анализа включали параметрические и непараметрические методы сравнения, данные представлены как М±d (среднее ± одно стандартное отклонение) в случае нормального распределения или в виде медианы с указанием интерквартильного диапазона. Различия считали статистически значимыми при p<0,05.












